
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сульфокислоти і сульфохлориди
|
|
|
|
Органічні сполуки, які містять у своїй молекулі атоми сульфуру, близькі до аналогічних оксигеновмісних сполук. Однак, розглядаючи ці речовини, необхідно враховувати особливості будови атома сульфуру. Являючись аналогом оксигену, сульфур у той же час відрізняється від нього своєю змінною валентністю і меншою електронегативністю.
Сульфурвмісні похідні аліфатичного ряду
Тіоли (тіоспирти) і алкілсульфіди (тіоефіри)
Тіоли (тіоспирти) і алкілсульфіди (тіоефіри) – аналоги звичайних спиртів і ефірів, в молекулах яких замість атома оксигену знаходиться атом сульфуру: R – SH, R – S – R¢.
Ці сполуки розглядають як похідні сірководню: якщо в його молекулі замістити один атом гідрогену на вуглеводневий радикал, утвориться тіоспирт, а якщо обидва – тіоефір.
Номенклатура. Тіоспирти за раціональною номенклатурою називають меркаптанами, наприклад, СН3SH – метилмеркаптан. За женевською номенклатурою назви тіоспиртів утворюють додаючи закінчення – тіол до назви вуглеводню:

| 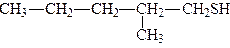
|
| етантіол | 2-метилпентантіол |
Тіоефіри, додаючи до назви радикалу закінчення - сульфід, або подібно до простих ефірів, назву групи R–S алкілтіо - додають до назви вуглеводню:

| 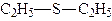
|
| метилетилсульфід | діетилсульфід |
Ізомерія. Ізомерія всіх сульфурвмісних сполук аліфатичного ряду обумовлена розгалуженням вуглецевого скелету.
Способи добування. 1. Взаємодія гідросульфіду калію з галогеналканами:
 .
.
2. Взаємодія спиртів з сірководнем за наявності каталізатора:
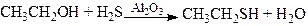 .
.
3. Алкілсульфіди утворюються шляхом алкілування солей тіолів – тіолятів:
 .
.
Фізичні властивості. Нижчі тіоли – рідини (за виключенням метантіолу) з сильним неприємних запахом. Тому деякі тіоспирти додають до природного газу як адоранти для виявлення його витоку в газопроводах. Тіоли погано розчиняються у воді і добре в багатьох органічних розчинниках. Вони киплять при більш низькій температурі, ніж відповідні їм спирти. Це пояснюється асоціацією їхніх молекул.
Тіоефіри – рідини з температурою кипіння, близькою до температури кипіння тіолу з тією ж молекулярною масою. Нерозчинні у воді, не мають неприємного запаху. Вищі тіоли і тіоефіри – тверді речовини.
Хімічні властивості. Тіоли володіють більш вираженими кислотними властивостями, ніж звичайні спирти.
1. При взаємодії з лугами вони утворюють солі – тіоляти (меркаптиди):
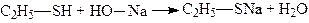 .
.
2. Тіоефіри легко утворюють комплексні сполуки при взаємодії з солями важких металів:
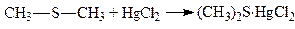 .
.
3. Тіоли і тіоефіри здатні до окислення. При цьому тіоли утворюють діалкілсульфіди (які можуть знову відновлюватися до тіолів) або, при більш енергійних окисниках, сульфокислоти:
 ,
,
 .
.
Тіоефіри при окисленні їх перекисом водню переходять в сульфоксиди:
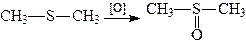 .
.
4. Використовуючи сильні окислювачі (KMnO4, конц. HNO3), можна із тіоефірів і тіолів одержувати сульфони:
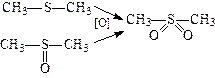 .
.
Сульфокислоти – похідні вуглеводнів, у яких атом гідрогену заміщений залишком сульфатної кислоти – сульфогрупою (– SO3H). У цій групі є два семиполярних зв’язки між атомами сульфуру й оксигену.
Номенклатура. Сполуки, які містять сульфогрупу називають, додаючи до назви вуглеводню приставку сульфо - або закінчення – сульфокислота:

| 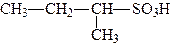
|
| пропан-1-сульфокислота | бутан-2-сульфокислота |
Способи одержання. 1. Сульфокислоти утворюються при окисленні тіолів нітратною кислотою або при дії на насичені вуглеводні концентрованою сульфатною кислотою:
 .
.
2. У промисловості алкансульфокислоти найчастіше одержують сульфохлоруванням або сульфоокисленням алканів.
а) Сульфохлорування. Реакція відкрита Рідом і Хорном. Вона заключається в дії на алкани сумішшю сульфуру (IV) оксиду і хлору під впливом каталізатору (органічні пероксиди або УФ-випромінювання). Сульфохлориди при омиленні лугами утворюють солі сульфокислот. Сульфохлорування є ланцюговим вільнорадикальним процесом:
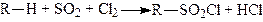 .
.
б) Сульфоокислення.
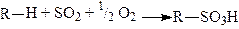 .
.
Фізичні властивості. Сульфокислоти – кристалічні речовини., розчинні у воді. Гігроскопічні.
Хімічні властивості. Алкансульфокислоти є сильними кислотами.
1. При дії на них лугів утворюють нейтральні солі – сульфонати:
 .
.
2. При дії галоїдних сполук фосфору на сульфокислоти утворюються відповідні сульфохлориди:
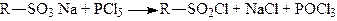 .
.
Сульфохлориди при омиленні легко перетворюються в солі сульфокислот, а останні при дії мінеральних кислот – сульфокислоти:
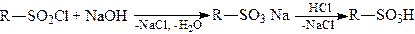 .
.
3. При взаємодії сульфохлоридів з надлишком аміаку одержують сульфаміди.
Застосування. Сульфурвмісні похідні аліфатичного ряду використовуються як: регулятори емульсійної полімеризації при виробництві каучуків; добавки до миючих речовин, емульгаторів та флотаційних реагентів.
|
|
|
|
|
Дата добавления: 2014-11-09; Просмотров: 3109; Нарушение авторских прав?; Мы поможем в написании вашей работы!