
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические источники электрической энергии
|
|
|
|
Устройства, которые применяют для непосредственного преобразования энергии химических реакций в электрическую энергию, называют гальваническими элементами или химическими источниками электрической энергии. Действие любого гальванического элемента основано на протекании в нем окислительно – восстановительной реакции.
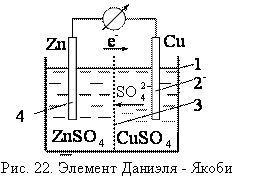
Классический пример гальванического элемента – элемент Даниэля – Якоби, он состоит из цинковой пластины (1), погруженной в раствор сульфата цинка и медной пластины (2), погруженной в раствор сульфата меди. Растворы разделены пористой перегородкой (4) (или электролитическим мостиком).
При замкнутой цепи цинк окисляется, ионы цинка переходят в раствор, электроны движутся по внешней цепи к медному электроду.
На медном электроде происходит восстановление ионов меди из раствора, медь выделяется на пластинке. Цинковый электрод является анодом, медный катодом, цинк растворяется, медь выделяется из раствора, сульфат анионы движутся через пористую перегородку от медного к цинковому электроду.
Процесс на аноде Zn = Zn+2 + 2e
Процесс на катоде Cu+2 + 2e = Cu
Суммарное уравнение: Zn + Cu+2 = Zn+2 + Cu
Молекулярное уравнение: Zn + CuSO4 = Zn SO4 + Cu
Кратко строение элемента Даниэля – Якоби можно записать следующей схемой:
Zn|ZnSO4(р) || CuSO4(р)|Cu
Таким образом, при работе гальванического элемента электроны от восстановителя переходят к окислителю по внешней цепи, на электродах идут электрохимические процессы, в растворе наблюдается направленное движение ионов. В настоящее время используются различные гальванические элементы: железо – никелевые, кадмиево – никелевые, серебряно – цинковые, свинцовые, и др. их называют аккумуляторами. В свинцовом аккумуляторе одни пластины заполнены дооксидом свинца, другие губчатым свинцом. Металлический свинец при работе аккумулятора является анодом и окисляется:
Pb + SO4-2 = PbSO4 +2e
Диоксид свинца является катодом, он восстанавливается:
PbO2 + SO4-2 + 4H+ + 2e = PbSO4 +2H2O
Суммарный процесс: Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
При зарядке, через аккумулятор пропускают электрический ток и в результате этого электрохимические процессы на электродах протекают в обратном направлении.
Свинцовый электрод становится катодом, на нем протекает процесс восстановления:
PbSO4 +2e = Pb + SO4-2
На электроде из PbO2 происходит процесс окисления:
PbSO4 + 2H2O = PbO2 + SO4-2 + 4H+ + 2e
 ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ
ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ
Электродвижущая сила гальванического элемента равна алгебраической сумме электродных потенциалов электродов.
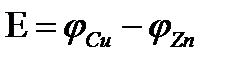


Скачок потенциала, возникающий на границе раздела металл – раствор его соли, называется электродным или окислительно – восстановительным потенциало (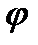 ). Зависимость электродного потенциала от природы металла, концентрации его ионов в растворе и температуры количественно выражается уравнением В. Нернста.
). Зависимость электродного потенциала от природы металла, концентрации его ионов в растворе и температуры количественно выражается уравнением В. Нернста. 
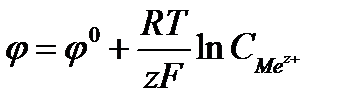 , где F - число Фарадея
, где F - число Фарадея
равно 96500Кл/моль, z – заряд иона, R – газовая постоянная 8,31Дж/моль·К, Т температура по Кельвину, 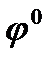 - стандартный электродный потенциал металла. Подставляя в формулу число Фарадея, температуру 298К, газовую постоянную и десятичный логарифм, получаем:
- стандартный электродный потенциал металла. Подставляя в формулу число Фарадея, температуру 298К, газовую постоянную и десятичный логарифм, получаем:

Стандартным электродным потенциалом металла  называется скачок потенциала на границе раздела металл - раствор его соли с концентрацией 1 моль/л.
называется скачок потенциала на границе раздела металл - раствор его соли с концентрацией 1 моль/л.
Для измерения электродных потенциалов собирают гальваническую цепь, состоящую из исследуемого электрода и стандартного водородного электрода. Водородный электрод представляет собой платиновую пластинку, насыщенную газообразным водородом, которая опущена в водный раствор кислоты. Потенциал стандартного водородного электрода принят равным нулю. Например: для цинкового электрода:
Zn|ZnSO4|| H2SO4 |H2,Pt
Потенциал цинкового электрода будет равен ЭДС такого гальванического элемента с обратным знаком, если берется медный электрод, то его потенциал будет равен ЭДС гальванического элемента.
Последовательность металлов, расположенных в порядке убывания (возрастания) значений их электродных потенциалов, называется рядом напряжения или рядом активности металлов. В гальванических элементах более активный металл является анодом (он растворяется при работе гальванического элемента), а менее активный катодом. Для расчета ЭДС гальванического элемента из потенциала менее активного металла отнимается потенциал более активного металла.
Например: стандартный потенциал цинкового электрода равен -0,76 В, медного 0,35В. ЭДС = 0,35 – (-0,76) = 1,11В.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 529; Нарушение авторских прав?; Мы поможем в написании вашей работы!