
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тестовые вопросы
|
|
|
|
Задачи для самостоятельной работы
Задача 1. На испарение 1 моля воды требуется 40 кДж. Сколько теплоты будет потеряно за день при выделении через кожу 720г воды?
Ответ: 1600 кДж
Задача 2. Пероксид водорода (Н2О2) в виде раствора с массовой долей 3 %. используется в медицине для обработки ран. Докажите, что процесс разложения пероксида водорода в присутствии фермента каталазы является самопроизвольным, используя для расчёта значения стандартной энтропии образования исходных веществ и продуктов реакции:
S0 298 (H2O2) =110 Дж/моль×К; S0 298 (Н2О) = 70 Дж/моль×К; S0298(O2) = 205 Дж/моль×К.
Ответ: Δ S = 62,5 Дж/моль × К
Задача 3. При сжигании метана объемом 2 м3 выделяется 79600 кДж теплоты. Рассчитайте стандартную теплоту сгорания метана.
Ответ: 891,52 кДж/моль
Задача 4. Рассчитайте стандартную энергию Гиббса для процесса окисления глюкозы по следующим данным: DН0обр (С6Н12О6) = - 1264,4 кДж/моль; DН0обр (СО2) = - 393 кДж/моль;
DН0обр (Н2О) = - 286 кДж/моль. Изменение энтропии всей реагирующей системы равно 0,259 кДж/моль×K
Ответ: DG = - 2886,8 кДж/моль.
Задача 5. Вычислите стандартную энтальпию образования этанола, воспользовавшись необходимыми для этого стандартными энтальпиями сгорания.
Ответ: DН0обр. = -273 кДж/моль
Задача 6. Константа равновесия реакции N2O4 (г) ↔ 2 NO2 (г) при 250С равна 0,1. В каком направлении будет идти реакция при следующих концентрациях веществ:
а) С(NO2) = С (N2O4) = 0,1 моль/л?
б) С(NO2) = 0,01 моль/л; С (N2O4) = 0,02 моль/л?
Задача 7. Для реакции H2 + I2 ® 2HI при 4440С константа равновесия равна 50. Определите направление процесса, если исходная смесь имеет следующий состав: С(H2) = 2моль/л, С(HI) = 10моль/л.
Ответ: Состояние равновесия, т.к ∆G=0.
Задача 8. Рассчитайте константу равновесия, если для данной реакции DG0 298 = - 4,478 кДж/моль.
Ответ: 6,1
Задача 9. Константа равновесия разложения лекарственного вещества в автоклаве при 413К равна 0,396∙105 Па, а при 443К - 1,286∙105 Па. Вычислить тепловой эффект реакции.
Ответ: 59,6 кДж/моль.
Задача 10. Используя значениеDG0, установите, существует ли угроза отравления при использовании в качестве наркотического средства оксида азота (I). Токсичный оксид азота (II) может образовываться по реакции 2N2O + O2↔4 NO. Все вещества находятся в газообразном состоянии. Для решения задачи используйте справочные данные.
1. Если энтальпия образования SO2 равна -297 кДж/моль, то количество теплоты, выделяемое при сгорании 16г серы, равно ____кДж.
1) 148,5 2) 297 3) 594 4)74,25
2. В реакции, протекающей в соответствии с термохимическим уравнением
3H2 + N2 = 2 NH3 + 92 кДж, выделилось 23 кДж теплоты. Объём полученного (при н.у.) аммиака равен____.
1) 5,6 л 2) 11,2л 3) 22,4л 4) 44,8л
3. По термохимическому уравнению реакции С2Н4 + Н2О ↔ С2Н5ОН +46 кДж
вычислите объём взятого этилена (н,у.), если известно, что выделившаяся в этом процессе теплота составила 138 кДж.
1) 44,8 л 2) 22,4л 3) 67,2 4) 89,6л
4. В реакцию, протекающую в соответствии с термохимическим уравнением
2Al + 3S = Al2S3 +509 кДж вступило 108 г алюминия. Количество выделившейся теплоты равно____.
1) 242,5 кДж 2) 509 кДж 3) 1018 кДж 4) 2036 кДж
5. В результате реакции, термохимическое уравнение которой 2Al +Fe2O3 = Al2O3 + 2 Fe +848 кДж, выделилось 169,6 кДж теплоты. Масса образовавшегося железа равна_____.
1) 11,2 г 2) 22,4 г 3) 56 г 4) 28 г
6. По термохимическому уравнению реакции горения ацетилена 2С2Н4 + 5О2 = 4СО2 + 2Н2О +2610 кДж рассчитайте, сколько выделится теплоты, если в реакцию вступило 67,2 л ацетилена (н.у.)
1) 870 кДж 2) 3915 кДж 3) 5220 кДж 4) 7830 кДж
7. В результате реакции, термохимическое уравнение которой 2С2Н4+ 5О2 = 4СО2 + 2Н2О +2610 кДж выделилось 652, 5 кДж теплоты. Объём сгоревшего ацетилена равен
1) 11,2 л 2) 22,4 л 3) 44,8 л 4) 67,2 л
8. Какое выражение соответствует константе химического равновесия для данной реакции
N2+3H2 = 2NH3
1) Kc = [NH3]2/ [N2]+[H2]3 3) Кр = [NH3]2 / [N2][H2]
2) Кс = [NH3]2 / [N2][H2]3 4) Кс = []N2][H2]3/ [NH3]2
9. Как нужно изменить давление, чтобы реакция гемоглобина с кислородом
Hb + O2 «HbO2 была смещена вправо?
1) уменьшить давление 2) увеличить давление 3) давление не влияет
10. Какое значение константы равновесия соответствует данной реакции 2NO +O2 «2NO2
1) Kc= [NO2]2/ [NO][O2] 3) Kc= [NO][O2]/ [NO2]2
2) Kc= [NO2]2 / [NO]2[O2] 4) Kc= [NO2]/ [NO][O2]
11. Как нужно изменить давление реакции N2+3H2 «2 NH3, чтобы сместить равновесие вправо?
1) уменьшить 3) не изменять
2) увеличить 4) увеличить давление NH3
12. Будет ли влиять давление на смещение равновесия данной реакции H2 + Cl2 = 2 HCl?
1) будет 2) нет
3) сместит равновесие вправо 4) сместит равновесие влево
13. Какие значения должна принимать энергия Гиббса, чтобы процесс шёл в обратном направлении?
1) DG0 < 0 2) DG0 > 0 3) DG0 = 0 4) DG0 = 1
14. Равновесие в реакции, уравнение которой СН4(г) + 4S(ж) ↔ СS2(г) + 2Н2S(г), ΔH<0, сместиться влево при ______.
1) понижении давления 3) дополнительном введении серы
2) понижении температуры 4) увеличении концентрации H2S
15. Будет ли протекать реакция в прямом направлении, если DG = 18 кДж/моль?
1) нет 2) химическое равновесие 3) будет
16. Система, в которой повышение давления и повышение температуры приведут к смещению равновесия в противоположных направлениях:
1) СO2(г) + C(т) ↔ 2СО(г), ΔН<0
2) J2(г) + 5 СО2(г) ↔ J2O5(т) + 5СО(г), ΔН>0
3) N2(г) + О2(г) ↔ 2 NO(г), ΔН>0
4) С2Н2(г) + 2Н2(г) ↔ С2Н6 (г), ΔН<0
17. Как нужно изменить давление, чтобы равнеовесие реакции гемоглобина с кислородом былаосмещено влево Hb + O2 «HbO2?
1) уменьшить давление 2) увеличить давление 3) давление не влияет
18. В реагирующей системе, уравнение которой NO(г) + Cl2(г) ↔ NOCl2(г) ΔH > 0, равновесие сместиться вправо при_____.
1) повышении давления 3) понижении температуры
2) использовании катализатора 4) повышении концентрации NOCl2
19. Для смещения равновесия в системе SO2(г)+Cl2(г)  SO2Cl2(г), DH°<0 в сторону продуктов реакции необходимо_____,
SO2Cl2(г), DH°<0 в сторону продуктов реакции необходимо_____,
1) понизить температуру 3) понизить концентрацию SO2
2) понизить давление 4) ввести катализатор 5) повысить температуру
20. На состояние химического равновесия в системе 2SO2(г) + О2 (г) ↔2 SO3, ΔH0 < 0 не влияет____
1) катализатор 3) изменение температуры
2) изменение концентрации исходных веществ 4) изменение давления
21. Для нахождения 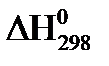 реакции
реакции  , следует воспользоваться формулой:
, следует воспользоваться формулой:
1) 
2) 
3) 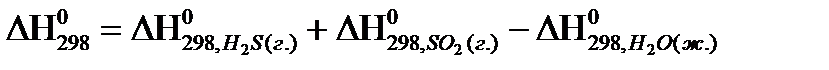
4) 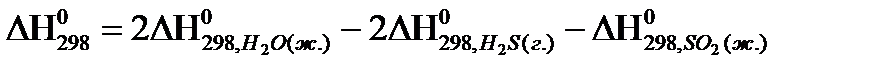
22. Для нахождения 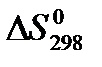 реакции
реакции  следует воспользоваться формулой: 1)
следует воспользоваться формулой: 1) 
2) 
3) 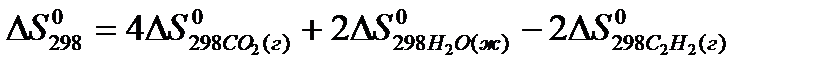
4) 
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 1443; Нарушение авторских прав?; Мы поможем в написании вашей работы!