
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Занятие 1.1.4
|
|
|
|
Повышение температуры кипения раствора по сравнению с чистым растворителем является следствием_________.
В случае равных моляльных концентраций наибольшее понижение температуры будет в растворе______.
Процесс перехода молекул растворителя через полупроницаемую мембрану из раствора с меньшей концентрацией в раствор с большей концентрацией называется___.
Растворимость газов в жидкости повышается при______.
Сольватирование частиц растворенного вещества является процессом_____.
1) Эндотермическим 3) Экзотермическим
2) Физическим 4) Необратимым
1) понижении температуры 3) повышении температуры
2) понижении давления газа 4) введении в жидкость электролитов
5. Зависимость растворимости газа от концентрации электролита в растворе описывается законом____. 1) Генри 3) Вант-Гоффа
2) Рауля 4) Сеченова
6. Осмотическое давление раствора глюкозы с молярной концентрацией 0,1 моль/л при 25°С равно _____ кПа.
1) 61,9 2) 51,6 3) 123,8 4) 247,6
7. Осмотическое давление раствора хлорида натрия с молярной концентрацией 0,1 моль/л (изотонический коэффициент 1,95) при 25 °С равно _____ кПа.
1) 247,6 2) 482,9 3) 20,8 4) 40,5
8. Уравнение π=СRT является математическим выражением закона_____.
1) Вант-Гоффа 3) Дальтона
2) Рауля 4) Сеченова
9. Осмолярная концентрация раствора глюкозы, если при температуре 25°С его осмотическое давление равно 247,6 кПа, составляет _____ моль/л.
1) 1,2 2) 0,12 3) 0,1 4) 12
1) электролитическая диссоциация 3) осмос
2) гидролиз 4) диффузия
11. Растворы хлорида натрия и глюкозы с одинаковой концентрацией имеют_______.
1) Одинаковое осмотической давление 3) Одинаковое давление пара над раствором
2) Разное осмотическое давление 4) Разный цвет
12. Водный раствор глюкозы с моляльной концентрацией 0,5 моль/кг замерзнет при температуре___°С. Криоскопическая постоянная воды равна 1,86 кг×К/моль.
1) – 0,93 2) 0,93 3) 0 4) – 3,72
13. Водный раствор глюкозы с моляльной концентрацией 1 моль/кг закипит при температуре ___°С. Эбулиоскопическая постоянная воды 0,516 кг×К/моль.
1) 0,516 2) 100,516 3) 273,516 4) 298,516
14. Растворы глицерина и глюкозы будут иметь одинаковое осмотическое давление при 25°С, если у них ____.
1) Одинаковый объем 3) Разная концентрация
2) Одинаковая концентрация 4) Разный объем
1) С6Н12О6 2) NaCl 3) KCl 4) CaCl2
1) понижения давления пара над раствором;
2) повышения давления пара над раствором;
3) повышения плотности раствора;
4) изменения поверхностного натяжения раствора.
ТЕМА: Протолитические реакции. Буферные растворы.
ЦЕЛЬ: Познакомиться с основами протолитических процессов, протекающих в организме человека, усвоить природу протолитического гомеостаза и возможные причины его нарушения.
ЗНАТЬ:
1. Основные положения протолитической теории кислот и оснований. Кислоты и основания по Бренстеду-Лоури, сопряженные кислоты и основания. Константы кислотности и основности. Показатели кислотности (рКа) и основности (рКb). Связь между константой кислотности и константой основности в сопряжённой протолитической паре.
2. Диссоциация воды. Ионное произведение воды. Водородный и гидроксильный показатели, рН биологических жидкостей.
3. Изменение рН органов и тканей при различных заболеваниях. Ацидоз. Алкалоз. Способы их устранения.
4. Гидролиз солей. Степень и константа гидролиза. Амфолиты. Изоэлектрическая точка.
5. Буферные системы. Механизм буферного действия систем I и II типа. Расчет рН буферных систем при добавлении сильной кислоты или сильного основания.
6. Буферное действие. Буферная ёмкость. Расчет буферной ёмкости по кислоте и по основанию. Факторы влияющие на буферную ёмкость.
7. Буферные системы крови. Сравнительная буферная емкость буферных систем крови. Бикарбонатная, фосфатная, белковая, гемоглобиновая буферные системы. Механизм действия. Формулы для расчета.
8. Применение реакции нейтрализации в фармакотерапии.
УМЕТЬ:
1. Самостоятельно пользоваться учебной, научной и справочной литературой.
2. Пользоваться химической посудой (бюретки, пипетки, конические колбы и т.д.).
3. Готовить буферные смеси с определёнными значениями рН среды и определять буферную ёмкость методом титрования.
5. Рассчитывать рН и рОН сильных (слабых) электролитов и буферных систем.
ВЛАДЕТЬ:
1. Навыками самостоятельной работы с учебной и справочной литературой.
2. Навыками приготовления буферных смесей.
3. Навыками оформления результатов и выводов экспериментальных работ.
Лабораторная работа №3 «Свойства буферных растворов»
Основные уравнения по теме:
«Протолитические реакции. Буферные растворы»
1. рKa = -lgKa - показатель константы кислотности
2. рKb =-lgKb - показатель константы основности
3. рH = -lg [H+] - водородный показатель среды
4. pOH = -lg [OH-] - гидроксильный показатель среды
5. [H+]×[OH-] = 1×10-14 - ионное произведение воды
pH + pOH = 14
6. 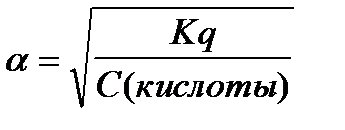 - закон разведения Оствальда
- закон разведения Оствальда
7. рH = 1/2 [pKa - lgC(1/z кислоты)] - расчет рН для растворов слабых кислот
8. pH = 14-1/2 [pKb - lgC(1/z основания)] - расчет рН для растворов слабых оснований
9. 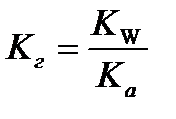 - расчёт константы гидролиза соли слабой кислоты и сильного основания
- расчёт константы гидролиза соли слабой кислоты и сильного основания
10. 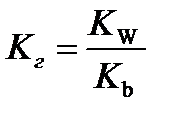 - расчёт константы гидролиза соли слабого основания и сильной кислоты
- расчёт константы гидролиза соли слабого основания и сильной кислоты
11. 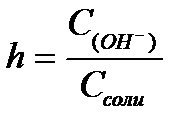 ,
, 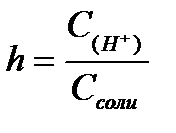 ,
, 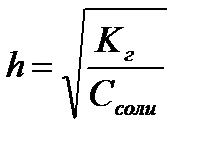 - степень гидролиза соли
- степень гидролиза соли
12. 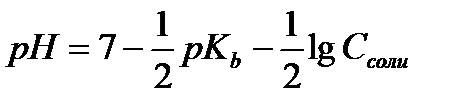 - расчёт рН раствора соли, гидролизующейся по катиону
- расчёт рН раствора соли, гидролизующейся по катиону
13. 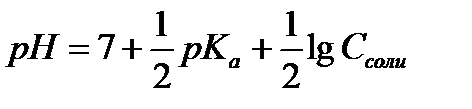 - расчёт рН раствора соли, гидролизующейся по аниону
- расчёт рН раствора соли, гидролизующейся по аниону
14. 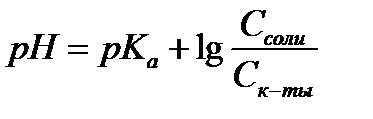 - расчет рН для буферных систем I типа
- расчет рН для буферных систем I типа
15. 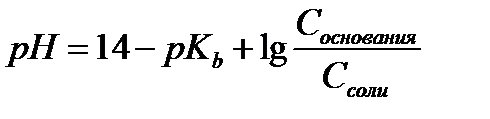 - расчет рН для буферных систем II типа
- расчет рН для буферных систем II типа
16. 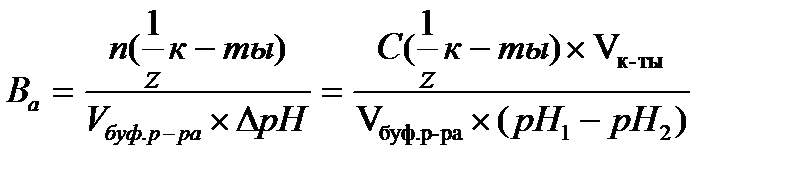 - определение буферной емкости по кислоте
- определение буферной емкости по кислоте
17. 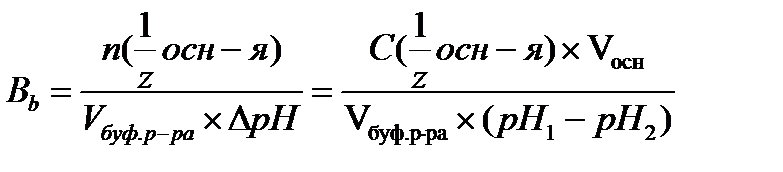 - определение буферной емкости по основанию
- определение буферной емкости по основанию
18. 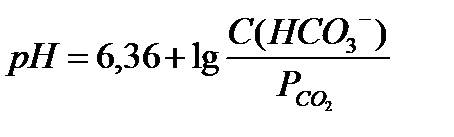 - уравнение Гендерсона-Гассельбаха для бикарбонатной буферной системы
- уравнение Гендерсона-Гассельбаха для бикарбонатной буферной системы
19. HHb + O2 + HCO3- = HbO2- + H2CO3 - суммарный процесс, протекающий в легочных капиллярах
20. HbO2- + H2CO3 = O2 + HHb + HCO3 - - суммарный процесс, протекающий в тканевых капиллярах
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 755; Нарушение авторских прав?; Мы поможем в написании вашей работы!