
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Занятие 1.1.3
|
|
|
|
ТЕМА: Растворы. Коллигативные свойства растворов.
ЦЕЛЬ: Изучить коллигативные свойства растворов и приобрести навыки криометрических измерений.
ЗНАТЬ:
1. Растворы, определение. Роль воды и растворов в жизнедеятельности. Физико-химические свойства воды, обуславливающие ее роль в качестве единственного биорастворителя. Строение воды, образование межмолекулярных водородных связей.
2. Концентрация растворов, способы ее выражения. Массовая доля, молярная концентрация, моляльная концентрация, молярная концентрация эквивалента, молярная доля и титр.
3. Зависимость растворимости вещества в воде от соотношения гидрофильных и гидрофобных свойств; влияние внешних условий на растворимость.
4. Понятие об идеальном растворе.
5. Закон Рауля и следствия из него: понижение температуры замерзания, повышение температуры кипения раствора.
6. Коллигативные свойства разбавленных растворов неэлектролитов.
7. Коллигативные свойства разбавленных растворов электролитов.
8. Осмос. Омотическое давление: закон Вант-Гоффа. Осмоляльность и осмолярность биологических жидкостей и перфузионных растворов.
9. Понятие о изоосмии. Роль осмоса в биологических системах. Плазмолиз, гемолиз.
10. Законы растворения газов в воде и биологических жидкостях.
УМЕТЬ:
1. Самостоятельно пользоваться учебной, научной и справочной литературой.
2. Пользоваться химическим оборудованием (термометром, прибором для криометрических измерений, химической посудой и т.д.).
3. Наблюдать за протеканием физических процессов и делать обоснованные выводы.
4. По экспериментально найденному понижению температуры замерзания раствора рассчитать изотонический коэффициент и осмотическую концентрацию.
5. Рассчитывать давление пара над раствором, температуру кипения, замерзания, осмотическое давление растворов электролитов и неэлектролитов, молярную массу вещества эбулиометрическим и криометрическим методом.
6. Уметь применять законы Генри, Дальтона и Сеченова при лечении кессонной болезни, лечении в барокамере и исследовании электролитного состава крови.
ВЛАДЕТЬ:
1. Навыками самостоятельной работы с учебной и справочной литературой.
2. Навыками безопасной работы в химической лаборатории.
3. Навыками оформления результатов и выводов экспериментальных работ.
Лабораторная работа №2 «Определение осмотической концентрации и изотонического коэффициента раствора электролита»
Основные уравнения по теме:
«Растворы. Коллигативные свойства растворов»
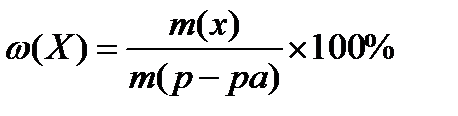 Способы выражения концентрации растворов:
Способы выражения концентрации растворов:
1. массовая доля (%)
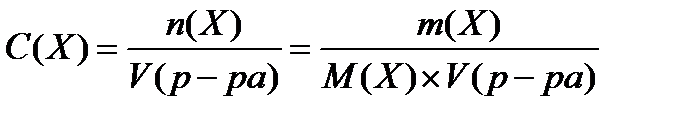
2. молярная концентрация (моль/л)
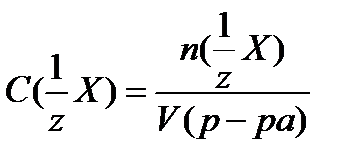 3. молярная концентрация эквивалента (моль/л)
3. молярная концентрация эквивалента (моль/л)
где,
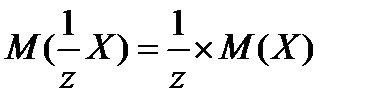
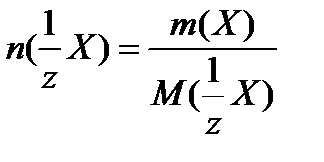
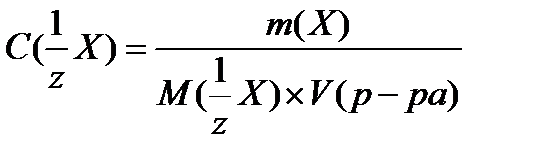
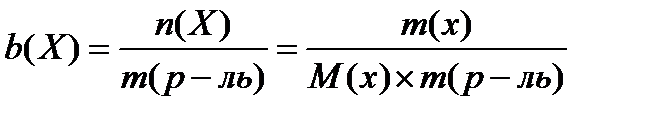
4. моляльная концентрация (моль/кг)
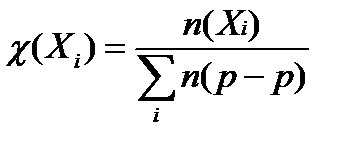
5. молярная доля
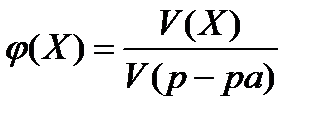
6. объёмная доля
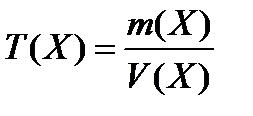
7. титр (г/мл)
8. P = P0× c (X1) закон Рауля
9. 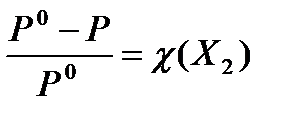 закон Рауля
закон Рауля
10. ∆Р = Р0×χ(Х2) закон Рауля
11. DTк = Кэ × b(x) - повышение температуры кипения растворов
12. D Tз = Кз × b(x) - понижение температуры замерзания растворов
13.
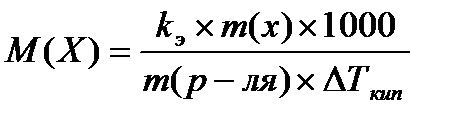 расчёт молярной массы вещества эбулиометрическим
расчёт молярной массы вещества эбулиометрическим
методом
14. 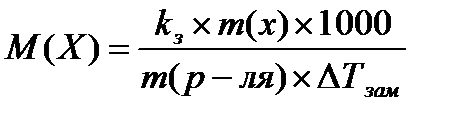 расчёт молярной массы вещества криометрическим
расчёт молярной массы вещества криометрическим
методом
15. p осм. = С(х) × RT - уравнение Вант-Гоффа
16. 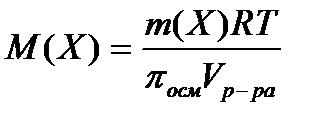 осмометрическое определение молярной массы вещества.
осмометрическое определение молярной массы вещества.
17. 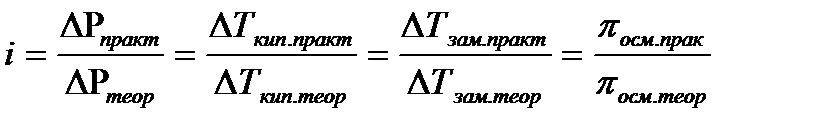 - расчет изотонического коэффициента
- расчет изотонического коэффициента
Уравнения коллигативных свойств растворов электролитов:
1. DP = i P0 c (X2)
2. DTкип = i ×Кэ ×b (х)
3. DTзам = i ×Кз × b (x)
4. p осм. = i ×C(х) ×R×T
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 861; Нарушение авторских прав?; Мы поможем в написании вашей работы!