
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Обучающие задачи
|
|
|
|
Стандартные энтальпии образования веществ, стандартные энтропии и стандартные энергии Гиббса образования веществ
| Вещество | Стандартная энтальпия образования кДж/моль | Стандартная энтропия Дж/моль×К | Стандартная энергия Гиббса образования кДж/моль |
| Неорганические вещества | |||
| С (графит) | +6 | ||
| СО (г) | -110 | +198 | -137 |
| СО2 (г) | -393,5 | +214 | -394 |
| Cl2 (г) | +223 | ||
| Cl2O (г) | +76 | +266 | +94 |
| FeСО3 (тв) | -753 | +96 | -680 |
| H2 (г) | +131 | ||
| HCl (г) | -92 | +187 | -95 |
| HI (г) | +24 | +206 | -1 |
| HNO2 (р-р) | -119 | +153 | -56 |
| HNO3 (ж) | -174 | +156 | -81 |
| H2O (ж) | -286 | +70 | -237 |
| H2O2 (ж) | -187 | +110 | -120 |
| H2S (г) | -21 | +206 | -34 |
| H2SO4 (ж) | -814 | +157 | -690 |
| KNO3 (тв) | -495 | +133 | -395 |
| KOH(р-р) | -477 | +92 | -441 |
| N2 (г) | +192 | ||
| NH3 (г) | -46 | +192 | -16 |
| H2O (г) | +82 | +220 | +104 |
| NO (г) | +91 | +211 | +87 |
| NO2 (г) | +33 | +240 | +51 |
| N2O3 (г) | +11 | +356 | +115 |
| Na2O2 (тв) | -510 | +95 | -447 |
| Na2S2O3 (тв) | -1117 | +225 | -1043 |
| O2 (г) | +205 | ||
| SO2 (г) | -297 | +248 | -300 |
| SO3 (г) | -396 | +257 | -371 |
| Органические вещества | |||
| Метан (г) | -75 | +186 | -51 |
| Этан (г) | -85 | +229 | -33 |
| Этилен (г) | +52 | +219 | +68 |
| Ацетилен (г) | +227 | +201 | +209 |
| Бензол (ж) | +49 | +173 | +125 |
| Циклогексан (ж) | -156 | +204 | +27 |
| Хлорметан (г) | -86 | +234 | -63 |
| Дихлорметан (г) | -95 | +270 | -69 |
| Трихлорметан (г) | -101 | +296 | -69 |
| Тетрахлорметан (г) | -100 | +310 | -58 |
| Метанол (ж) | -239 | +127 | -166 |
| Этанол (ж) | -277 | +161 | -174 |
| Диэтиловый эфир (ж) | -279 | +253 | -123 |
| Ацетальдегид (г) | -166 | +264 | -133 |
| Ацетон (ж) | -247 | +199 | -154 |
| Пируват-ион (р-р) | + | -559 | |
| L-молочная кислота (р-р) | -686 | +222 | -539 |
| Сахароза (тв) | -2222 | +360 | -1545 |
| D-глюкоза (р-р) | -1264 | +269 | -917 |
| Нитробензол (ж) | +16 | +224 | +146 |
| Анилин (ж) | +31 | +191 | +149 |
| L-лейцин (р-р) | -643 | +208 | -362 |
| Глицин (р-р) | -523 | +159 | -380 |
| D,L-лейцилглицин (р-р) | + | -464 | |
| Глицилглицин (р-р) | -734 | +231 | -492 |
Стандартные энтальпии сгорания органических веществ, кДж/моль
| Метан (г) | -890 | Этанол (ж) | -1371 |
| Ацетилен (г) | -1300 | Диэтиловый эфир (ж) | -2727 |
| Бензол (ж) | -3268 | Нитробензол (ж) | -3091 |
| Циклогексан (ж) | -3920 | Анилин (ж) | -3396 |
| Метанол (ж) | -727 | Глюкоза | -2802 |
Удельная теплота полного окисления веществ в условиях организма, кДж/г.
| Условный белок | |
| Условный жир | |
| Углеводы |
Задача 1. В организме человека реакция окисления этилового спирта протекает в две стадии. Первая - окисление этилового спирта до уксусного альдегида с участием фермента алкогольдегидрогеназы протекает по уравнению: С2H5OH + ½ O2 = CH3COH + H2O.
Рассчитайте DH0 реакции, используя первое следствие закона Гесса, если
DН0 обр.(C2H5OH) = - 278 кДж/моль;
DН0 обр.(CH3СOH) = - 166 кДж/моль;
DН0 обр.(H2O) = - 286 кДж/моль.
Решение: DH0 = å n DH0 обр.пр.р. - å n DН0 обр.исх.в.в; DH = (-166+ (-286)-(-278)) = - 174 кДж/моль
Ответ: тепловой эффект реакции DH = -174 кДж/моль, т.е. процесс экзотермический.
Задача 2. Теплота сгорания глюкозы равна -2810 кДж/моль, теплота сгорания этилового спирта равна -1366 кДж/моль. На основании этих данных вычислите тепловой эффект биохимического процесса брожения глюкозы:
С6Н12О6= 2С2Н5ОН + 2СО2
Решение: Тепловой эффект данной реакции можно рассчитать, применяя второе следствие из закона Гесса:
DН = ån DН0 сгор. исход. веществ - å n DH0 сгор. прод. реакции
DН = -2810 - 2 ∙(-1366) = - 78 кДж/моль
Ответ: тепловой эффект процесса брожения равен - 78 кДж/моль.
Задача 3. Рассчитайте стандартную энтропию реакции:
NH2 - CH2 - COOH + NH2 - CH2 - COOH → NH2 - CH2 - CO - NH - CH2 - COOH + H2O
глицин глицин глицилглицин
Если S0 (глицилглицина) = 231 Дж/моль×К;
S0 (глицина) = 159 Дж/ моль×К; S0(H2O) = 70 Дж/моль×К;
Решение:
DS = S0298(гл-гл) +S0298(H2O)– 2 S0 298(глицина) = (231+70)-(159+159)= -17 Дж/моль×К
Ответ: DS0 298= - 17 Дж/моль×К, т.е. энтропия уменьшится.
Задача 4. Теплота сгорания углеводов, белков и жиров составляет 17, 17 и 39 кДж
соответственно. Среднесуточная потребность в белках, жирах и углеводах для студентов - мужчин составляет 113, 106 и 451г. Какова суточная потребность студентов - мужчин в энергии?
Решение: Рассчитываем, сколько энергии выделяется при окислении углеводов, белков и жиров
DH = (451×17) + (113 × 17) + (106 × 39) = 13722 кДж.
Ответ: Суточная потребность в энергии равна 13722 кДж.
Задача 5. Почему процесс денатурации белка при 400С является самопроизвольным, если реакция эндотермическая и тепловой эффект составляет 2830 Дж/моль? Значение DS для данной реакции равно 288 Дж/моль∙К
Решение: Для определения направления процесса необходимо знать величину изменения энергии Гиббса, рассчитываемой по уравнению: DG0 = DH0 - TDS0. Расчет показывает, что DG < 0 (DG0 = 2830 Дж/моль - (313К × 288 Дж/моль∙К) = - 87314 Дж/моль или - 87,3 кДж/моль).
Ответ: Поскольку DG < 0, то процесс денатурации белка при 400С протекает самопроизвольно, повышение температуры тела может представлять опасность для жизнедеятельности организма.
Задача 6. Вычислите энергию Гиббса, являющуюся критерием самопроизвольности процессов, для реакции гликолиза при стандартных условиях: С6H12О6 (р-р) ® 2С3H6О3 (р-р) (молочная кислота).
Решение:
Из таблицы термодинамических величин запишем стандартную энергию Гиббса для участников химического процесса: ∆G0 (С6H12О6) = -917 кДж/моль; ∆G0(С3H6О3) = -539 кДж/моль. Используя 1 следствие из закона Гесса вычислим энергию Гиббса:
ΔG0 = 2×ΔG0 (C3H6O3) - ΔG0 (C6H12O6)
ΔG0 = 2(-539) – (-917) = -161 кДж/моль
Ответ: т.к. ΔG0 < 0, то реакция протекает самопроизвольно в прямом направлении.
Задача 7. Вычислить изменение энергии Гиббса при 250С по стандартным значениям энтальпий образования и абсолютных энтропий для данной реакции: СО + 2Н2 = СН3ОН
DН0обрСН3ОН = -293 кДж/моль S0(СН3ОН) = 127 Дж/моль×К
DН0обрСО = - 110 кДж/моль. S0(CO) = 198 Дж/моль×К
S0(H2) = 131 Дж/моль×К
Решение: DG0 = DH0 - TDS0
DH0 = ånDH0обр. пр. реак. - ånDН0обр. исх. веществ
DН0 = - 293 - (-110) = - 183 кДж/моль
DS0 = å n S0 прод. р - å n S0 исход. веществ
DS0 = 127 - (198 + 2(131) = - 333 Дж/моль×К
DG0 = - 183,5 кДж/моль - (298К × 0,333 кДж/моль×К) = - 83,8 кДж/моль
Ответ: DG0 = - 83,8 кДж/моль
Задача 8. Рассчитайте константу равновесия при 310 К для реакции АТФ + АМФ↔2 АДФ, если свободная энергия Гиббса реакции ΔG°=-2,1 кДж/моль
Решение: в состоянии равновесия DG0 = - 2,3RT lg Кс
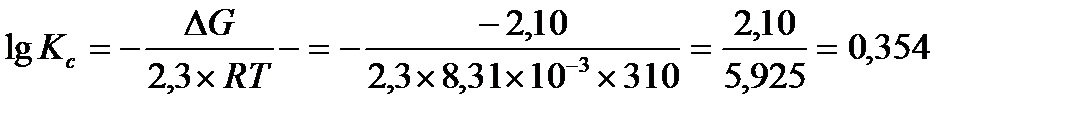
lgKc= 0,354
Kc= 100,354=2,26
Ответ: Kc = 2,26
Задача 9. Константа равновесия реакции: PCl5(г) «PCl3(г) + Cl2(г) при 2500С равна 2. В каком направлении идет реакция при следующих концентрациях: С(PCl5) = C(PCl3) = 2 моль/л; С(Сl2) = 4 моль/л?
Решение: Для определения направления протекания реакции воспользуемся уравнением изотермы 
Рассчитаем Пс
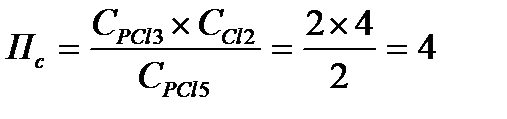
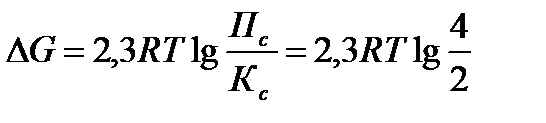
Т.к. Пс > Кс, то DG > 0
Вывод: реакция самопроизвольно протекать в прямом направлении не может, т.к. DG>0.
Задача 10. Константа равновесия реакции 2SO2 (г) + O2(г) Û 2SO3(г) при температуре 6270С равна 2,3∙10-7, DН0 = 376,5 кДж/моль. Рассчитайте константу равновесия при 7270С.
Решение: воспользуемся уравнением изобары химической реакции:
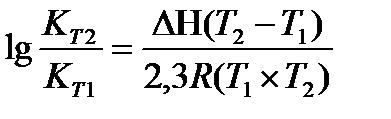
T1 = 273 + 627 = 900 K
T2 = 273 + 727 = 1000K
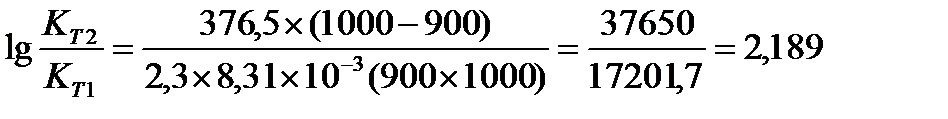
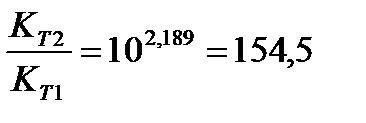

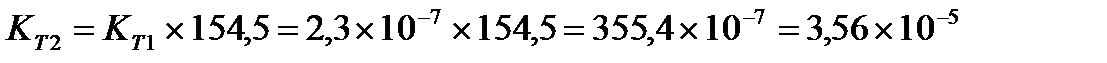

Ответ: Константа равновесия при 7270С равна 3,56 × 10-5.
Задача 11. Для реакции Н2О(г) + СO(г) ® CO2(г) + H2(г) константы химического равновесия равны: при 8000С Кр = 2,87, при 10000С Кр = 1,39. Вычислите тепловой эффект этой реакции.
Решение: Применив, уравнение изобары химической реакции, рассчитаем DН
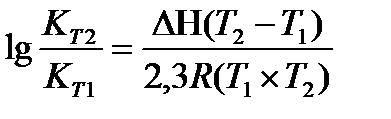
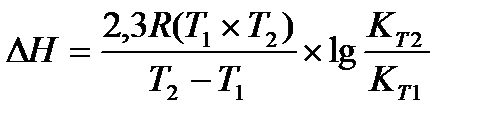
Перевёдём температуру в Кельвины: T1 = 800 + 273 = 1073 K
T2 = 1000 + 273 = 1273 K
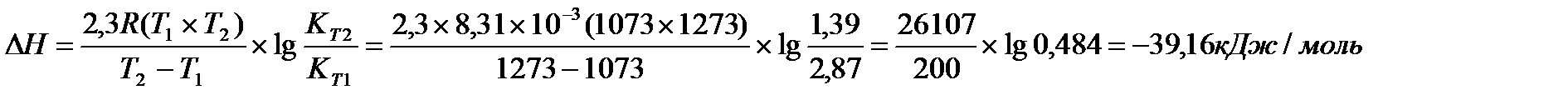 Ответ: DН = -39,16 кДж/моль.
Ответ: DН = -39,16 кДж/моль.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 482; Нарушение авторских прав?; Мы поможем в написании вашей работы!