
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Очевидно, что для обратимого процесса
|
|
|
|
Первый закон термодинамики является универсальным законом природы. Он полностью справедлив и для живых организмов. Наличие энергетического баланса для живого организма показывает, что организм не является источником новой энергии и, следовательно, подчиняется первому началу термодинамики.
Второй закон термодинамики устанавливает критерий направленности термодинамических процессов. Известно несколько формулировок второго закона:
1. Формулировка поКлаузиусу. Теплота не может самопроизвольно переходить от более холодного тела к более горячему.
2. Формулировка поОствальду. Вечный двигатель второго рода невозможен (т.е. не существует машины, которая бы полностью превращала теплоту в работу).
3. Формулировка поКельвину. Невозможно получать работу, только охлаждая отдельное тело ниже температуры самой холодной части окружающей среды.
Приведем ещё одну формулировку, связанную с энтропией:
Каждая термодинамическая система обладает функцией состояния – энтропией (S), причем
dS 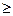
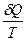 , (28)
, (28)
Знак «равно» относится к обратимым процессам, а знак «больше» - к необратимым.
Для изолированнойсистемы второй закон термодинамики можно записать в виде неравенства Клаузиуса
dS 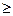 0 (29)
0 (29)
Таким образом, в реальных процессах энтропия изолированной системы возрастает и достигает максимального значения в состоянии равновесии.
 (30)
(30)
Отсюда легко получить соотношения для определения величины DS в различных обратимых процессах:
- Изотермический процесс (фазовые превращения первого рода – плавление, испарение, возгонка, превращение кристаллических модификаций)
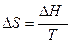 (31)
(31)
где DН - изменение энтальпии при фазовом переходе,
- Нагревание или охлаждение в изобарных условиях
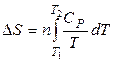 (32)
(32)
- Нагревание или охлаждение в изохорных условиях
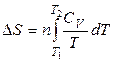 (33)
(33)
– Изменение энтропии в процессах с идеальным газом
 =
=  (34)
(34)
Если же требуется вычислить изменение энтропии в необратимом процессе, необходимо провести обратимый процесс между теми же начальным и конечным состояниями использовать тот факт, что энтропия – функция состояния, следовательно, ее изменение не зависит от пути процесса.
Первый и второй законы термодинамики можно объединить в так называемый объединенный первый и второй закон термодинамики, который для обратимых процессов записывается в виде
ТdS = dU + pdV (35)
В отличие от других термодинамических функций, энтропия имеет точку отсчёта, которая задаётся постулатом Планка (третьим законом термодинамики):
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 448; Нарушение авторских прав?; Мы поможем в написании вашей работы!