
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Связь между различными константами выражается уравнениями
|
|
|
|
 , (48)
, (48)
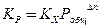 (49)
(49)
где D n – изменение числа молей газообразных участников реакции.
Величина константы равновесия КР и КС зависит только от природы реагирующих веществ и температуры.
Согласно принципу Ле Шателье – Брауна, если на систему, находящуюся в состоянии истинного равновесия, оказывается внешнее воздействие, то в системе возникает самопроизвольный процесс, компенсирующий данное воздействие.
Изменение ∆rG или ∆rW в химической реакции при заданных парциальных давлениях или концентрациях реагирующих веществ можно рассчитать по уравнению изотермы химической реакции (изотермы Вант - Гоффа):
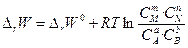 (50)
(50)
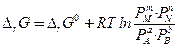 (51)
(51)
где Сi и Рi – неравновесные концентрации и парциальные давления исходных веществ и продуктов реакции
Если система находится в состоянии химического равновесия, то изменение соответствующего термодинамического потенциала равно нулю. Получаем:
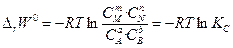 (52)
(52)
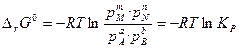 (53)
(53)
Здесь Сi и Рi – равновесные концентрации и парциальные давления исходных веществ и продуктов реакции.
Уравнения (52) и (53) используют для расчёта констант равновесия КР и КС по термодинамическим данным.
Зависимость константы равновесия от температуры описывается уравнением изобары и изохоры Вант-Гоффа:
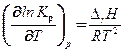 (54)
(54)
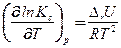 (55)
(55)
Здесь DrН и DrU – изменение энтальпии и внутренней энергии в ходе реакции (т.е. тепловой эффект реакции при Р = const и V = const, соответственно).
Для точного описания равновесий в реальных системах вместо давления вводится величина фугитивности или летучести (f), a вместо концентрации - величина активности (а). Они отличаются от давления и концентрации соответственно на множитель, называемый коэффициентом активности.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 419; Нарушение авторских прав?; Мы поможем в написании вашей работы!