
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Или мольный процент
|
|
|
|
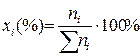 (4)
(4)
Очевидно, что 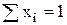 .
.
3) молярная концентрация (молярность, СМ, моль∙л-1) – отношение количества молей растворенного вещества ni к объему раствора V р (л)
СМ  , (5)
, (5)
где m – масса растворенного вещества, г;
М – молекулярная масса растворенного вещества.
4) молярная концентрация эквивалентов (эквивалентная концентрация, нормальность С, моль–экв∙л-1) – отношение количества моль–эквивалентов растворенного вещества nэ к объему раствора V р (л)
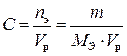 , (6)
, (6)
где m – масса растворенного вещества, г;
МЭ –эквивалентная масса растворенного вещества (масса моль –эквивалента).
5) моляльная концентрация(моляльность mi, моль∙кг-1) – количество молей растворенного компонента, приходящееся на 1000 г растворителя
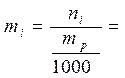
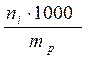 (7)
(7)
где ni – число молей растворенного компонента,
mр – масса растворителя (г).
Растворение - это самопроизвольный процесс, всегда сопровождающийся увеличением энтропии системы. Если при этом отсутствуют какие-либо тепловые или объемные эффекты (ΔmixН = 0, ΔmixV = 0), то образуется идеальный раствор. Для идеальных растворов силы взаимодействия между однородными и разнородными молекулами одинаковы.
Рассмотрим некоторые особенности образования растворов различных типов.
1) Газообразное состояние вещества характеризуется слабым взаимодействием между частицами и большими расстояниями между ними. Поэтому газы смешиваются практически в любых соотношениях (при очень высоких давлениях, когда плотность газов приближается к плотности жидкостей, может наблюдаться ограниченная растворимость). Для газовых смесей справедлив закон Дальтона: общее давление газовой смеси равно сумме парциальных давлений всех входящих в неё газов
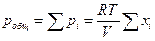 (8)
(8)
 , (9)
, (9)
где хi – мольная доля.
2) Растворимость газов в жидкостях зависит от ряда факторов: природы газа и жидкости, давления, температуры концентрации растворенных в жидкости веществ и др.
Зависимость растворимости газов от давления выражается законом Генри – Дальтона: растворимость газа в жидкости прямо пропорциональна его давлению над жидкостью
 (10)
(10)
Здесь С – концентрация раствора газа в жидкости, k – коэффициент пропорциональности, зависящий от природы газа.
Закон Генри – Дальтона справедлив только для разбавленных растворов при малых давлениях, когда газы можно считать идеальными.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 1250; Нарушение авторских прав?; Мы поможем в написании вашей работы!