
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Из уравнения Гиббса следует, что адсорбцию растворенного вещества можно определить по понижению поверхностного натяжения жидкости с ростом концентрации этого вещества в растворе
|
|
|
|
Уравнение Эйнштейна для коэффициента диффузии является одним из основных в коллоидной химии, с его помощью можно определить размер частиц коллоидных растворов и молекулярную массу полимеров.
Из уравнения Эйнштейна-Смолуховского следует, что величина 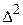 обратно пропорциональна радиусу частицы r. Это означает, что чем крупнее частица, тем меньше величина ее смещения. С увеличением размера частиц прежде всего прекращается поступательное броуновское движение, затем исчезает вращательное движение и остается только колебательное.
обратно пропорциональна радиусу частицы r. Это означает, что чем крупнее частица, тем меньше величина ее смещения. С увеличением размера частиц прежде всего прекращается поступательное броуновское движение, затем исчезает вращательное движение и остается только колебательное.
Осмос – процесс односторонней диффузии растворителя через полупроницаемую перегородку от раствора с меньшей концентрацией растворенного вещества к раствору с большей концентрацией. Давление, которое нужно приложить в процессе осмоса к раствору, чтобы привести его уровень к уровню чистого растворителя, называют осмотическим давлением (p). Осмотическое давление является коллигативным свойством раствора. В коллоидных растворах роль отдельной «молекулы» играет коллоидная частица, состоящая из множества молекул.
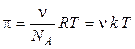 , (4)
, (4)
где k = R / NA = 1,38·10-23 Дж·К-1 – константа Больцмана,
n - частичная концентрация.
Осмотическое давление коллоидных растворов намного меньше, чем для истинных растворов такой же массовой концентрации, так как из–за больших размеров число коллоидных частиц в единице объема намного меньше числа молекул в истинном растворе.
Седиментацией называют процесс оседания частиц дисперсной фазы в жидкой или газообразной среде под действием силы тяжести. Всплывание частиц (например, капель в эмульсиях) носит название обратной седиментации.
Скорость оседания частиц не зависит от их природы, а определяется размером частиц, разностью плотностей частиц ρ и среды ρ0 и вязкостью среды. Скорость оседания шарообразных частиц с радиусом r равна
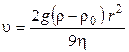 , (5)
, (5)
где g — ускорение силы тяжести.
Для частиц произвольной формы уравнение для скорости седиментации дает эквивалентный радиус r (радиус сферической частицы, оседающей с той же скоростью).
Способность к седиментации часто выражают через константу седиментации, величина которой определяется как отношение скорости седиментации кускорению свободного падения g:
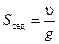 . (6)
. (6)
Константа седиментации зависит от размеров частиц, их плотности и плотности среды, температуры. Величина, обратная константе седиментации, является мерой кинетической устойчивости дисперсной системы:
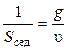 . (7)
. (7)
Процесс седиментации постепенно приводит дисперсную систему к упорядоченному состоянию, так как оседающие частицы располагаются по высоте в соответствии с их размерами (в нижних слоях преобладают крупные, затем более мелкие). Однако процессу седиментации противодействуют броуновское движение и диффузия, стремящиеся распределить частицы равномерно по всему объему дисперсионной среды. В результате устанавливается равновесие, характеризуемое неоднородным распределением частиц по высоте столба суспензии − седиментационно-диффузионное равновесие, которое описывается гипсометрическим законом Лапласа-Перрена:

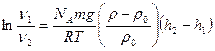 , (8)
, (8)
где ν1 и ν2 – частичные концентрации на высотах h1 и h2, соответственно,
m – масса частицы,
NA – число Авогадро,
g – ускорение свободного падения,
p – плотность вещества, из которого состоит частица,
p0 – плотность дисперсионной среды.
Поверхностное натяжение (σ, Дж∙м-2, Н∙м-1) - сила, действующая на единицу длины границы раздела фаз и обуславливающая сокращение поверхности жидкости. Эта сила направлена тангенциально к поверхности жидкости.
Для увеличения поверхности жидкости необходимо затратить работу по преодолению сил внутреннего давления. Если р, Т = const, то такой процесс приводит к увеличению поверхностной энергии Гиббса:
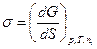 . (9)
. (9)
Поверхностное натяжение зависит от температуры (с увеличением температуры σ понижается почти по линейному закону), природы жидких веществ, диэлектрической проницаемости веществ, величины диполя и поляризуемости молекул.
Адсорбция – это самопроизвольное концентрирование вещества на твердой или жидкой поверхности раздела фаз.
Адсорбируемое вещество называется адсорбатом, а адсорбирующее – адсорбентом.
Различают химическую и физическую адсорбцию. При химической адсорбции образуются химические связи, а физическая адсорбция вызвана лишь ван-дер-ваальсовым взаимодействием. При повышении температуры физическая адсорбция понижается. Нагревание повышает энергию адсорбирующихся молекул и соответственно усиливает химическую адсорбцию.
Движущей силой адсорбции является избыточная поверхностная энергия на границе раздела фаз.
Рассмотрим системы жидкость-газ; жидкость-жидкость.
Для характеристики адсорбции используют полную (абсолютную) адсорбцию А, которую выражают через количество вещества, адсорбированного единицей поверхности или массы адсорбента (моль∙см-2, г∙см-2, моль∙г-1, г∙г-1), и удельную (избыточную) или гиббсовскую адсорбцию Г, которая характеризует избыток адсорбированного компонента в поверхностном слое по сравнению с его количеством в объеме фазы, приходящийся на единицу площади раздела фаз (моль∙м-2, кг∙м-2).
Важным в теории адсорбции является уравнение Гиббса, связывающее адсорбцию Г растворенного вещества с изменением поверхностного натяжения раствора:
 , (10)
, (10)
где С – равновесная концентрация вещества в растворе.
Вещества, понижающие поверхностное натяжение на границе раздела фаз, называются поверхностно – активными (ПАВ), для них 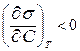 ,
,
К этой группе относятся органические соединения с несимметричным строением молекул, состоящих из полярных и неполярных групп. Полярными свойствами обладают такие атомные группировки, как –СООН, − ОН, − NН2, − СНО, − SO2OH и др. Эти группы способны к гидратации и являются гидрофильными. Неполярная часть молекул ПАВ представляет собой гидрофобную углеводородную цепь или радикал.
Молекулы, в которых имеются гидрофильная и гидрофобная группировки называют дифильными.
Вещества, увеличивающие поверхностное натяжение на границе раздела фаз, называются поверхностно-инактивными (ПИВ). Для них 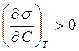 .
.
Если 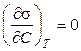 , то адсорбция будет равна нулю.
, то адсорбция будет равна нулю.
Величина 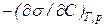 называется поверхностной активностью вещества. Она обозначается через G (в честь Гиббса).
называется поверхностной активностью вещества. Она обозначается через G (в честь Гиббса).
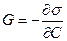 (11)
(11)
Поверхностная активность – это мера способности вещества понижать поверхностное натяжение.
Для органических предельных спиртов и кислот в гомологических рядах соблюдается правило Дюкло – Траубе: увеличение цепи на одну СН2-группу увеличивает поверхностную активность гомолога в 3 – 3,5 раза в водном растворе.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 574; Нарушение авторских прав?; Мы поможем в написании вашей работы!