
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Коагулирующее действие оказывает ион, заряд которого противоположен заряду коллоидной частицы. Например, для положительно заряженного золя AgI
|
|
|
|
Повышение температуры, интенсифицируя броуновское движение, препятствует осаждению частиц и, следовательно, повышает кинетическую устойчивость системы. Однако при интенсификации броуновского движения увеличивается возможность слипания частиц в результате их столкновения, что снижает агрегативную устойчивость коллоидного раствора и приводит к укрупнению частиц. Это, в свою очередь, приводит к уменьшению кинетической устойчивости коллоидной системы.
На основе перемещения пигментов в клетках работают электрофорезные дисплеи спортивных табло. Электрофорез заставляет двигаться заряженные частицы дисперсной фазы в направлении силовых линий электрического поля.
Все электрокинетические явления основаны на наличии двойного электрического слоя на границе твердой и жидкой фаз.
Уравнение Гельмгольца – Смолуховского связывает величину электрокинетического потенциала (ξ ‑потенциала) со скоростью электрофореза заряженных частиц
 , (20)
, (20)
где k — коэффициент, зависящий от формы частиц (для сферических частиц k = 6, для цилиндрических k = 4);
η – вязкость среды;
υ – линейная скорость перемещения частиц (или границы золя);
ε – относительная диэлектрическая проницаемость среды;
Е – напряженность поля (градиент потенциала).
Знание величины ξ-потенциала позволяет судить об устойчивости коллоидного раствора.
Электроосмос, как и электрофорез, получил широкое практическое применение. В качестве медицинской процедуры электрофорез применяют для транспорта лекарственных веществ через биологические мембраны. На кожу пациента накладывают тампон лекарственного препарата, а сверху – электроды, к которым приложен низкий, безопасный для организма потенциал. Молекулы лекарственного препарата под действием электрического поля переходят в ткани организма; в результате уменьшаются боли, улучшается кровообращение, ликвидируются воспалительные процессы, восстанавливаются поврежденные ткани.
Изоэлектрическое состояние. Значение ξ ‑потенциала зависит от количественного распределения противоионов между вторым адсорбционным и диффузным слоями. Чем меньше противоионов во втором адсорбционном слое, тем больше ξ ‑потенциал. При добавлении электролита повышается концентрация ионов в растворе и происходит их внедрение в мицеллу, прежде всего в диффузный слой. Далее ионы электролита того же знака, как и притивоионы мицеллы, способны сами переходить во второй адсорбционный слой либо частично вытесняют туда противоионы мицеллы из диффузного слоя. При этом диффузный слой уменьшается по толщине (сжимается) и ξ ‑потенциал уменьшается. При достаточно большой концентрации прибавленного электролита (порог коагуляции) величина заряда второго адсорбционного слоя приближается к величине заряда первого адсорбционного слоя (т. е. заряда потенциалопределяющих ионов). При этих условиях ξ ‑потенциал стремится к нулю. При ξ = 0, когда образовался своеобразный конденсатор из первого и второго адсорбционных слоёв, общий заряд частицы равен 0 и частица находится в изоэлектрическом состоянии. Сжатие диффузионного слоя одновременно сопровождается потерей частицами защитной сольватной оболочки. В связи с потерей электрического заряда и защитной сольватной оболочки, т. е. двух основных факторов агрегативной устойчивости, происходит слипание коллоидных частиц (коагуляция).
Под устойчивостью коллоидной системы понимают ее способность сохранять без изменения малый размер частиц и равномерное распределение их в объеме.
Устойчивость коллоидных сист ем классифицируется на кинетическую (или седиментационную) и агрегативную.
1). Кинетическая (седиментационная) устойчивость – это способность вещества дисперсной фазы, то есть коллоидных частиц, находиться во взвешенном состоянии, равномерно распределяться по всему объему раствора и не оседать под действием силы тяжести. Кинетическая устойчивость обязана малому размеру частиц (10-5 – 10-7 см), которым еще присуще хаотическое броуновское движение, затухающее с увеличением размера частиц.
2). Агрегативная устойчивость характеризуется способностью частиц дисперсной фазы оказывать сопротивление их слипанию и тем самым сохранять определенную дисперсность в целом, или способность коллоидной системы противостоять процессам, ведущим к уменьшению свободной поверхностной энергии на межфазной поверхности.
Эта устойчивость обусловлена в основном наличием у коллоидных частиц одноименных зарядов (при сближении частиц увеличиваются силы отталкивания между ними). Другим фактором является образование на поверхности частиц сольватных оболочек из молекул растворителя. При некотором упрощении можно считать, что сольватная оболочка сформирована за счет сольватации ионов диффузного слоя. Исследования показали, что сольватные оболочки благодаря своей упругости и повышенной вязкости препятствуют слипанию частиц, производя «расклинивающее действие».
Коагуляция (слипание) коллоидных частиц происходит в результате столкновений при броуновском движении. Коагуляцию могут вызывать: длительный диализ, механические воздействия, сильное охлаждение или нагревание, пропускание электрического тока, действие ультразвука, старение, добавление электролитов и неэлектролитов.
Все электролиты при определенной концентрации способны вызвать коагуляцию коллоидных систем. При этом коагуляция обусловлена потерей обоих факторов агрегативной устойчивости. Скрытая (медленная) коагуляция соответствует начальной медленной стадии, когда не каждое столкновение коллоидных частиц приводит к образованию крупных агрегатов; ее трудно обнаружить визуально, поскольку частицы укрупняются, но еще не теряют седиментационную устойчивость. При явной коагуляции каждое столкновение частиц приводит к образованию агрегатов, что сопровождается изменением цвета системы, образованием мути и выпадением осадка.
Правила коагуляции коллоидных систем электролитами.
1). Для начала коагуляции необходимо превысить некоторую минимальную концентрацию электролита. Эта величина, выраженная в ммоль∙л-1, называется порогом медленной коагуляции СК. Величина, обратная порогу коагуляции, называется коагулирующей способностью Р. Концентрация электролита, с которой скорость коагуляции перестает зависеть от концентрации, называется порогом быстрой коагуляции.
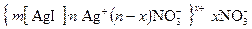 .
.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 708; Нарушение авторских прав?; Мы поможем в написании вашей работы!