
- Р Р‡.МессенРТвЂВВВВВВВВжер
- ВКонтакте
- РћРТвЂВВВВВВВВнокласснРСвЂВВВВВВВВРєРСвЂВВВВВВВВ
- РњРѕР№ Р В Р’В Р РЋРЎв„ўР В Р’В Р РЋРІР‚ВВВВВВВВРЎР‚
- LiveJournal
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ионная сила в водном растворе AgCl составит
|
|
|
|
Равна
Откуда
Активности катионов и анионов определяем по уравнениям
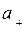 =
= 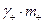 и
и 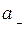 =
= 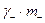
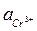 = 0,0458×0,2 = 0,0092;
= 0,0458×0,2 = 0,0092; 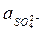 = 0,0458×0,3 = 0,0137
= 0,0458×0,3 = 0,0137
Пример 7. Экспериментально найдено, что в 0,01 н растворе KCl средний коэффициент активности ионов 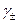 равен 0,922, а в 0,01 н растворе KNO3 —
равен 0,922, а в 0,01 н растворе KNO3 — 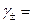 0,916. Определить значение
0,916. Определить значение 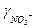 .
.
Решение. В соответствии с правилом Мак – Иннеса для 0,01 н раствора KCl:
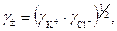
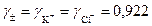 .
.
С другой стороны, по определению для 0,01 н раствора KNO3:
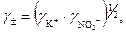
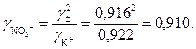
Пример 8. Определить ионную силу раствора, содержащего на 1000 г воды 0,01 моль 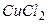 и 0,1 моль
и 0,1 моль 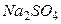 .
.
Решение. Ионная сила такого раствора равна
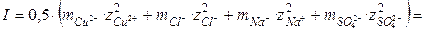
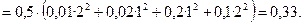
Пример 9. Растворимость AgCl в воде при 25°C равна 1,274×10-5 моль∙кг-1. Рассчитать растворимость AgCl в водном растворе K2SO4 концентрации 0,020 моль∙кг-1.
Решение. Константа равновесия для реакции
AgCl(тв) = Ag+(aq) +Cl-(aq)
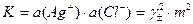
I = 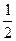 (1,274×10-5 12 + 1,274×10-5 12) =1,274×10-5 моль∙кг -1.
(1,274×10-5 12 + 1,274×10-5 12) =1,274×10-5 моль∙кг -1.
Так как концентрация AgCl чрезвычайно мала (S = m = 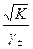 ), принимаем коэффициент активности равным 1.
), принимаем коэффициент активности равным 1.
При расчёте растворимости AgCl в растворе K2SO4 средний ионный коэффициент активности снижается.
Ионная сила 0,020 моль∙кг-1 раствора K2SO4 равна
I= 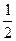 (2×0,020×12+0,020×22) =0,060 моль∙кг- 1.
(2×0,020×12+0,020×22) =0,060 моль∙кг- 1.
Тогда lgg±= -0.509(0.060)1/2 = ‑0,12,
откуда g±=0,76.
Следовательно, растворимость AgCl в растворе K2SO4 составит
S = K1/2/g±=(1,62×10-10)1/2/0,76=1,7×10-5 моль∙кг- 1.
Пример 10. В 0,01М раствор сульфата двухвалентного металла опущены платиновые электроды. Поверхность каждого электрода составляет 10 см2, расстояние между ними 4 см. Эквивалентная электропроводность раствора равна 100 Ом-1×(моль экв)-1×см2. Какое напряжение нужно приложить к электродам, чтобы через раствор протекал ток силой 0,1 А?
Решение. Определяем удельную электропроводность раствора
æ 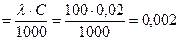 Ом-1×см-1.
Ом-1×см-1.
|
|
|
Дата добавления: 2014-11-16; Просмотров: 1665; Нарушение авторских прав?; Мы поможем в написании вашей работы!