
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Константа диссоциации
|
|
|
|
Следовательно
Падение напряжения на электродах составит
Находим сопротивление раствора
R = l / æ ∙S 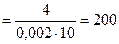 Ом,
Ом,
U = I×R = 0,1×200 = 20 В.
Пример. 11. В сосуд для измерения электрической проводимости, заполненный 1/32 н СН3СООН, помещены электроды площадью S = 3·10-4 м2 на расстоянии l = 2·10-2 м друг от друга. При напряжении U = 10 В через раствор идет ток силой I = 4,3058·10-3 А при T = 298 K. Определить степень диссоциации, константу диссоциации и рН раствора, если при указанной температуре предельные подвижности ионов H+ и CH3COO– соответственно равны: 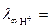 34,982·10-3 См м2 моль-экв-1,
34,982·10-3 См м2 моль-экв-1,  4,090·10-3 См м2 моль-экв-1.
4,090·10-3 См м2 моль-экв-1.
Решение.
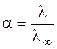 ,
, 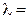 æ / C, æ
æ / C, æ  ,
, 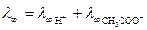 .
.
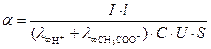

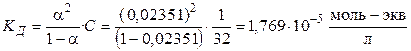 ,
,

Пример 12. Определить  при 18оС, если при этой температуре известны подвижности следующих ионов и ацетата калия:
при 18оС, если при этой температуре известны подвижности следующих ионов и ацетата калия:
| Ионы, соль | К+ | Н+ | СН3СООК |

| 64,6 | 314,0 | 100,1 |
Решение. Используем закон Кольрауша:
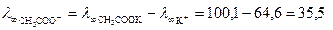 см2×Ом-1 моль-экв-1,
см2×Ом-1 моль-экв-1,
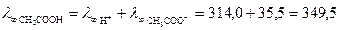 см2×Ом-1 моль-экв-1.
см2×Ом-1 моль-экв-1.
Примеры решения задач к разделу «Электрохимия»
Пример 1. Рассчитайте ЭДС и запишите схему гальванического элемента, в котором при 1013,25 кПа (1атм.) и 298 К обратимо протекает реакция:
2Fe3+ + HAsO2 + 2H2O = 2Fe2+ +H3AsO4 +2H+
Принять следующие активности ионов, участвующих в реакции:
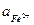 = 0,005;
= 0,005; 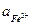 = 0,02;
= 0,02; 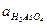 = 0,2;
= 0,2; 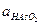 = 0,1;
= 0,1; 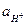 = 0,01;
= 0,01;  = 1.
= 1.
Решение. Очевидно, что одной из предполагаемых электродных реакций будет:
2Fe3+ + 2е= 2Fe2+
Для нахождения второй электродной реакции вычтем из суммарного уравнения первую реакцию:
2Fe3+ + HAsO2 + 2H2O = 2Fe2+ +H3AsO4 +2H+
2Fe3+ + 2е= 2Fe2+
H3AsO4+2H++ 2е= HAsO2+ 2H2O.
Тогда схема элемента:
Pt ½ H+,H3AsO4, HAsO2||Fe3+,Fe2+,H2O ½ Pt.
Стандартные электродные потенциалы электродов этого элемента равны:
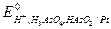 = 0,560 В;
= 0,560 В;
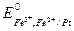 = 0,771 В.
= 0,771 В.
Вычисляем электродные потенциалы по уравнению Нернста:
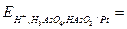
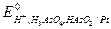 +
+  =
=
= 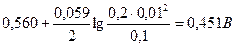 .
.
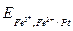
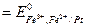 +
+ 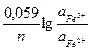 =
= 
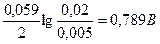 .
.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 1383; Нарушение авторских прав?; Мы поможем в написании вашей работы!