
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Характеристика вагонов 81-717(714) 7 страница
|
|
|
|
СО х -т (—2) = 0 х = + 2
С02 х + 2 (-2) = 0 х = + 4
СН4 х + 4(+ 1)^0 л: =—4
С2Нб 2* + 6(+ 1) = 0 х = — 3
С2Н5ОН 2х + 6 (+1) + (-2) = 0 х= — 2
Для установления степени окисленности элементов в соединениях можно пользоваться таблицей электроотрицательностей элементов (табл. 6). При этом следует иметь в виду, что при образовании химической связи электроны смещаются к атому более электроотрицательного элемента. Так, относительная электроотрицательность фосфора равна 2,2, а иода 2,6. Поэтому в соединении Р1з общие электроны смещены к атомам иода и степени окисленности фосфора и иода равны соответственно -f-З и —1. Однако в нитриде иода NI3 степени окисленности азота и иода равны —3 и +1, поскольку электроотрицательность азота (3,07) выше элек-троотрнцательности иода.
94. Окислительно-восстановительные реакции. Все химические реакции можно разбить на две группы. В реакциях первой группы окисленность всех элементов, входящих в состав реагирующих веществ, остается неизменной, а в реакциях второй группы окисленность одного или нескольких элементов изменяется.
В качестве примера реакций первой группы можно привести реакцию нейтрализации:
НС1 + NaOH = NaCl + Н20
Примером реакции второй группы может служить взаимодействие металла с кислотой:
Zn + 2НС1 = ZnCl2 + Н2|
Если при реакции нейтрализации ни один элемент не изменяет степень своей окисленности, то во втором примере степень окисленности цинка изменяется от 0 до +2, а водорода—от +1 до 0.
Реакции, в результате которых изменяются степени окисленности элементов, называются окислительно-восстановительными.
УЗ. Составление уравнений окислительно-восстановительных реакций
Окислительно-восстановительные реакции имеют очень большое значение в биологических системах. Фотосинтез, дыхание, пищеварение — все это цепи окислительно-восстановительных реакций. В технике значение окислительно-восстановительных реакций также очень велико. Так, вся металлургическая промышленность основана на окислительно-восстановительных процессах В ходе которых металлы выделяются из природных соединений.
Простым примером окислительно-восстановительной реакции может служить реакция образования ионного соединения из простых веществ, например, взаимодействие натрия с хлором:
2Na + С12 = 2NaCl
Эта реакция, как всякая гетерогенная реакция, протекает в несколько стадий. В ходе одной из них атомы натрия превращаются в положительно заряженные ионы; степень окисленности натрия изменяется от 0 до -f 1:
Na = Na+ + е~
Такой процесс — отдача электронов, сопровождающаяся повышением степени окисленности элемента,— называется окислением.
Электроны, отдаваемые натрием, принимаются атомами хлора, которые превращаются при этом в отрицательно заряженные ионы; степень окисленности хлора изменяется от 0 до —1:
С12 + 2е~ = 2СГ
Присоединение электронов, сопровождающееся понижением степени окисленности элемента, называется восстановлением.
Таким образом, в рассматриваемой реакции натрий окисляется, а хлор восстанавливается.
Вещество, в состав которого входит окисляющийся элемент, называется восстановителем, а вещество, содержащее восстанавливающийся элемент, окислителем. Следовательно, в данном примере натрий — восстановитель, а хлор — окислитель.
Из уравнений процессов восстановления и окисления видно, что одна молекула хлора, восстанавливаясь, присоединяет два электрона, а окисление одного атома натрия сопровождается отдачей одного электрона. Общее число электронов в системе при химических реакциях не изменяется: число электронов, отдаваемых молекулами (атомами, ионами) восстановителя, равно числу электронов, присоединяемых молекулами (атомами, ионами) окислителя. Поэтому одна молекула хлора может окислить два атома натрия.
95. Составление уравнений окислительно-восстановительных реакций. В § 94 мы рассмотрели простейший пример окислительно-восстановительной реакции — образование соединения из двух простых веществ. Обычно уравнения окислительно-восстановительных реакций носят более сложный характер и расстановка коэффициентов в них часто представляет довольно трудную задачу; приведем несколько примеров.
Пример 1. Взаимодействие между иодоводородом и концентрированной серной кислотой. Эта реакция протекает согласно схеме: hi + h2s04 —> i2-f-h2s+h20
Если мы подсчитаем степень окисленности каждого элемента в исходных веществах и в продуктах реакции, то увидим, что она изменяется у иода и у серы. У иода в HI она равна —1, а в свободном иоде 0. Степень же окисленности серы изменяется от +6 (в H2S04) до —2 (в H2S). Таким образом, степень окисленности иода повышается, а серы — понижается. Следовательно, иод окисляется, а сера восстанавливается.
Уравнение процесса окисления иода имеет простой вид:
21" = 12 + 1е~ (окисление) Уравнение восстановления серы более сложно, так как и исходное вещество (H2S04 или SO4""), и продукт реакции (H2S) кроме серы содержат другие элементы. При составлении этого уравнения будем исходить из того, что реакция протекает в кислой водной среде, а ион SO4- превращается в молекулу H2S:
soj;—> h2s
Четыре атома кислорода, высвобождающиеся при этом процессе, должны связаться в четыре молекулы воды. Для этого понадобятся восемь ионов водорода. Кроме того, два иона водорода необходимы для образования молекулы H2S. Следовательно, с ионом SOf" должны взаимодействовать десять ионов водорода: БОГ + 10н+ -—> h2s + 4Н20
Суммарный заряд ионов, находящихся в левой части этой схе-' мы, равен восьми элементарным положительным зарядам, а в правой ее части имеются лишь незаряженные частицы. Поскольку суммарный заряд в ходе процесса не изменяется, то, следовательно, в процессе восстановления принимают участие также восемь электронов:
SOl" + юн+ + 8е~ = h2S + 4Н20 (восстановление)
В рассматриваемом примере отношение числа электронов, принимаемых в процессе восстановления, к числу электронов, высвобождающихся- при окислении, равно 4: 1. Для получения суммарного уравнения реакции надо, складывая уравнения процессов восстановления и окисления, учесть это соотношение — умножить уравнение восстановления на 4. При этом в записи обычно справа от вертикальной черты проставляются необходимые множители:
2Г = 12 + 2е SOr + 10н+ + 8<?~ = h2s + 4н20
SO4" -1- 8г + 10н+ = 4i2 + h2s + 4н20
95. Составление уравнений окислительно-восстановительных реакций
25?
Полученное уравнение реакции может быть представлено и с молекулярной форме:
H2S04 + 8HI = 4I2 + H2S + 4Н20
Пример 2. Взаимодействие алюминия с нитратом калия в щелочной среде. Схема реакции:
КЖ)3 + А1 + КОН + Н20 —> Ш3 + КАЮ2
Здесь степень окисленности изменяется у азота и алюминия. Металлический алюминий (степень окисленности равна 0) превращается в ион AlOjT. в котором степень окисленности алюминия равна +3. Для составления уравнения окисления будем исходить из схемы:
А1 —* A10J
В щелочной среде источником кислорода, необходимого для протекания этого процесса, служат ионы ОН-. Для связывания одного атома алюминия в ион AlOJ необходимо четыре гидроксид-иона:
А1 + 40Н" —* A10J+2H20
В левой части схемы имеются четыре отрицательных заряда, а в правой — один. Следовательно, в ходе процесса отдаются три электрона:
Al + 40Н" = AlOJ + 2Н20 + Зе~ (окисление)
Для получения уравнения восстановления будем исходить из схемы:
N03" —>• NH3
Здесь в ходе процесса атомы азота лишаются атомов кислорода и связываются с атомами водорода. В щелочной среде это возможно при участии молекул воды. Три молекулы воды понадобятся для связывания трех атомов кислорода и еще три молекулы, воды — для образования молекулы NH3:
N03- + 6H20 —> NH3 + ЭОН-Суммарный заряд правой части схемы равен девяти отрицательным зарядам, а левой — одному. Следовательно, в процессе принимают участие восемь электронов:
N03" + 6Н20 + 8е~ = Ш3 -f- 90Н" (восстановление)
Отношение числа электронов, высвобождающихся в процессе окисления, к числу электронов, принимаемых при восстановлении, в данном примере равно 3:8. Следовательно, для получения суммарного уравнения реакции необходимо сложить уравнения процессов окисления и восстановления, умножив первое из них на 8, а второе на 3
Al + 40Н" = A10.J + 2Н20 + Зе~ + NO3 + 6Н20 + 8е~ — NH3 + 90Н"
8А1 + 3NO3 + БОН" + 2Н20 = 8АЮ2" + 3NH3 или в молекулярной форме:
8А1 + 3KN03 + 6КОН + 2Н20 = 8КАЮ2 + 3NH3
Пример 3. Каталитическое окисление аммиака. Этой реакцией пользуются в производстве азотной кислоты (см. § 143)'. Ее осуществляют при температуре около 750°С. Схема реакции:
NH3 + 02 —> NO + H20
При 750 °С конденсация водяного пара невозможна. Поэтому мы не будем записывать уравнения процессов окисления и восстав новления так, как это делалось для реакций, протекающих в водной среде — с участием молекул воды, ионов водорода или гидроксид-ионов. Подсчитаем лишь число электронов, принимающих участие в окислении и восстановлении. При этом учтем, что повышение степени окисленности элемента равно числу отданных, а понижение — числу принятых электронов.
Согласно схеме реакции, степень окисленности изменяется у азота и у кислорода. У азота она возрастает от —3 до +2, а у кислорода уменьшается от 0 до —2. Запишем эти изменения в виде схем, отмечая степени окисленности элементов над их сим-, волами. Во избежание путаницы с зарядом иона, будем при этом пользоваться римскими цифрами:
N_tn —> N+n + Ье~ (окисление) 0\ + 4е~ ■—>■ 20_ 11 (восстановление)
Отношение числа электронов, принимаемых при восстановлении, к числу электронов, высвобождающихся при окислении, равно 4:5. Следовательно, пять молекул кислорода могут окислить четыре молекулы аммиака:
4NH3 + 502 = 4NO + 6Н20
Составление уравнений реакций в трех рассмотренных приме-' pax проведено в определенном порядке. Его можно придерживаться и в других случаях при составлении уравнений окислительно-восстановительных реакций. Последовательность действий при этом следующая:
1. Составить схему реакции с указанием исходных и образующихся веществ.
2. Определить степень окисленности элементов в веществах правой и левой части схемы; отметить элементы, степень окисленности которых изменяется.
3. Составить уравнения процессов восстановления и окисления; найти отношение числа электронов, принимаемых при восстановлении и отдаваемых при окислении.
4. Сложить уравнения окисления и восстановления с учетом найденного отношения числа электронов (п. 3).
98. Важнейшие окислители и восстановители. Какие вещества могут проявлять свойства окислителей, а какие — восстановителей? Как уже говорилось, окислитель содержит в своем составе элемент, понижающий степень своей окисленности, а восстановитель содержит элемент, степень окисленности которого повышается в ходе реакции. Следовательно, окислителями могут быть прежде всего соединения высших, а восстановителями — низших степеней окисленности, присущих данному элементу.
Металлы проявляют в своих соединениях только положительную окисленность, и низшая их степень окисленности равна нулю. Иначе говоря, низшей степенью окисленности они обладают только в свободном состоянии. Действительно, все свободные металлы способны, хотя и в различной степени, проявлять только восстановительные свойства. На практике в качестве восстановителей применяют алюминий, магний, натрий, калий, цинк и некоторые другие металлы. Если металлу присущи несколько степеней окисленности, то те его соединения, в которых он проявляет низшую из них, также обычно являются восстановителями, например, соединения железа(П), олова(П), хрома(П), меди(1).
Окислителями могут быть те соединения металлов, в которых степень окисленности металла велика — равна номеру группы, в которой находится металл, или близка к нему. На практике применяют, в частности: аммиачный раствор оксида серебра, аммиачный раствор сульфата меди (II), хлорид ртути(II), диоксид свинца РЬ02, хлорид железа(III), хромат и дихромат калия (К2СЮ4 и К2СГ9О7), перманганат калия КМп04, диоксид марганца Мп02.
Неметаллы проявляют как положительную, так и отрицательную окисленность. Естественно, что соединения, содержащие неметаллы в высших положительных степенях окисленности, могут быть окислителями, а соединения, в которых неметалл проявляет отрицательную окисленность, —■ восстановителями.
К широко применяемым в промышленности восстановителям относятся водород, углерод (в виде угля или кокса) и монооксид углерода СО.
К сильным окислителям принадлежат неметаллы верхней части VI и VII групп периодической системы. Сильные окислительные свойства этих веществ объясняются большой электроотрицательностью их атомов. Сильнее всего окислительные свойства выражены у фтора, но в практике чаще пользуются в качестве окислителей кислородом, хлором и бромом.
К соединениям, применяемым в качестве окислителей, относятся также кислоты. Наибольшее практическое значение имеют соляная, серная и азотная кислоты. При этом элементом окислителем в соляной кислоте является водород, в азотной — азот, в разбавленной серной — водород, в концентрированной — сера. Поэтому уравнение процесса восстановления соляной и разбавленной серной кислот имеет вид:
2Н+ + 2е~ = Н2
Азотная кислота, в зависимости от ее концентрации, температуры и природы восстановителя, может восстанавливаться до различных степеней окисленности азота (см. § 142). Одним из обычных продуктов ее восстановления является оксид азота N0:
NO3 + 4Н+ + Зе~ = N0 + 2Н20
При восстановлении концентрированной серной кислоты также могут образовываться различные продукты (см. § 130). Одним из них может быть диоксид серы:
SO!- + 4Н+ + 2е~ = S02 + 2Н20
Из других соединений неметаллов, применяемых в качестве окислителей, можно указать на пероксид водорода, соли кислот, в которых кислотообразующий элемент проявляет высокую степень окисленности — хлораты (КСЮ3), перхлораты (КСЮ4).
97. Окислительно-восстановительная двойственность. Внутримо-
лекулярное окисление-восстановление. Соединения высшей степени
окисленности, присущей данному элементу, могут в окислительно-
восстановительных реакциях выступать только в качестве окисли-
телей, степень окисленности элемента может в этом случае только
понижаться. Соединения низшей степени окисленности могут быть,
наоборот, только восстановителями; здесь степень окисленности
элемента может только повышаться. Если же элемент находится
в промежуточной степени окисленности, то его атомы могут, в за-
висимости от условий, как принимать, так и отдавать электроны.
В первом случае степень окисленности элемента будет понижаться,
во втором — повышаться. Поэтому соединения, содержащие эле-
менты в промежуточных степенях окисленности, обладают окис-
лительно-восстановительной двойственностью —
способностью вступать в реакции как с окислителями, так и с вос-
становителями. •
Так, азот образует соединения, в которых степень его окисленности изменяется от —3 (аммиак и соли аммония) до +5 (азотная кислота и ее соли). Азот, входящий в состав аммиака, может выступать только в качестве восстановителя, азот азотной кислоты— только в качестве окислителя. Азотистая же кислота HNO2 и ее соли, где степень окисленности азота равна +3, вступают в реакции как с сильными окислителями, так и с сильными восстановителями. В первом случае HNO2 окисляется до азотной кислоты, во втором — восстанавливается обычно до оксида азота N0,
В качестве примеров окислительно-восстановительной двойственности азотистой кислоты можно привести реакции:
5KN02 + 2KMn04 + 3H2S04 = 5КМ03 + 2MnS04 + K2S04 + 3H20 2HN02 + H2S = 2NO + S + 2H20
Кроме азотистой кислоты окислительно-восстановительной двойственностью обладают сера, иод, пероксид водорода и ряд других веществ.
Вещества, содержащие элемент в промежуточной степени окисленности, обладают в ряде случаев еще одним характерным свойством. Оно состоит в том, что в определенных условиях такое вещество претерпевает процесс, в ходе которого часть элемента окисляется, а часть — восстанавливается. Этот процесс называется самоокислением-самовосстановлением. Так, при взаимодействии хлора с водой получается смесь соляной и хлорноватистой (НСЮ) кислот:
С12 + Н20 = НС1 + НСЮ
Здесь и окисление, и восстановление претерпевает хлор; С12 + 2Н20 = 2НС10 + 2Н+ + 2е~ (окисление) С12 + 2е~ = 2С1- (восстановление)
Самоокисление-самовосстановление называют также диспро-> порционированием.
Некоторые сложные вещества в определенных условиях (обычно при нагревании) претерпевают внутримолекулярное окисление-восстановление. При этом процессе одна составная часть вещества служит окислителем, а другая — восстановителем. Примерами внутримолекулярного окисления-восстановления могут служить многие процессы термической диссоциации. Так, в ходе термической диссоциации водяного пара
2Н20 = 2Н2 + 02
кислород окисляется (его степень окисленности возрастает от —2 до 0), а водород восстанавливается (его степень окисленности уменьшается от -f-1 до 0).
Другим примером может служить реакция разложения нитрита аммония, применяемая в лабораторной практике для получения.чистого азота:
NH4N02 = N2 + 2Н20
Здесь ион NH* окисляется, а ион NOJ восстанавливается до свободного азота.
98. Химические источники электрической энергии. Мы уже знаем, что при любой окислительно-восстановительной реакции происходит переход электронов от восстановителя к окислителю.
Так, при опускании цинковой пластинки в раствор сульфата меди происходит реакция
Zn + Cu2+ = Cu+ Zn2+
Здесь восстановитель — цинк — отдает электроны. Эта полу-, реакция выражается уравнением:
Zn = Zn2+ + 2е~
Окислитель — ион меди — принимает электроны. Уравнение этой полуреакции имеет вид:
Си2+ + 2е~ = Си
В рассматриваемом примере обе полуреакции протекают в ме-1 сте соприкосновения цинка с раствором, так что электроны непосредственно переходят от атомов цинка к ионам меди. Можно, однако, осуществить эту реакцию таким способом, что окислительная и восстановительная полуреакции окажутся пространственно разделенными, а электроны будут переходить от восстановителя к окислителю не непосредственно, а по проводнику электрического тока — по внешней цепи. Этот направленный поток электронов представляет собою электрический ток. При таком осуществлении окислительно-восстановительной реакции ее энергия будет превращена в электрическую энергию, которую можно использовать, включив во внешнюю цепь устройство, потребляющее электрическую энергию (например, электронагревательный прибор, электрическую лампу и т. п.).
Устройства, которые применяют для непосредственного преобразования энергии химической реакции в электрическую энергию, называются гальваническими элементами. Их называют также химическими источниками электрической энергии (сокращенно ХИЭЭ) или химическими источниками тока.
В технике гальваническими элементами принято называть только ХИЭЭ, в которых протекают практически необратимые реакции. Такие ХИЭЭ обычно нельзя перезаряжать: они предназначены для однократного использования (в один или несколько приемов). ХИЭЭ, в которых протекают практически обратимые реакции, называют аккумуляторами: их можно перезаряжать и использовать многократно.
Действие любого гальванического элемента основано на протекании в нем окислительно-восстановительной реакции. В простейшем случае гальванический элемент состоит из двух пластин или стержней, изготовленных из различных металлов и погруженных в раствор электролита. Такая система делает возможным пространственное разделение окислительно-восстановительной реакции: окисление протекает на одном металле, а восстановление—• на другом. Таким образом, электроны передаются от восстанови-.,теля к окислителю по внешней цепи.
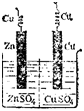
Рассмотрим в качестве примера медно-цинковый гальванический элемент, работающий за счет энергии приведенной выше реакции между цинком и сульфатом меди (рис. 82). Этот элемент (элемент Якоби — Даниэля) состоит из медной пластины, погруженной в раствор сульфата меди (медный электрод), и цинковой пластины, погруженной в раствор сульфата цинка (цинковый электрод). Оба раствора соприкасаются друг с другом, но для предупреждения смешивания они разделены перегородкой, изготовленной из пористого материала.
При работе элемента, т. е. при замкнутой цепи, цинк окисляется: на поверхности его соприкосновения с раствором атомы цинка превращаются в ионы и, гидратируясь, переходят в раствор. Высвобождающиеся при этом электроны движутся по внешней цепи к медному электроду. Вся совокупность этих процессов схематически изображается уравнением полуреакции, или электрохимическим уравнением:
Zn = Zn2+ + ге-На медном электроде протекает восстановление ионов меди. Электроны, приходящие сюда от цинкового электрода, соединяются с выходящими из раствора дегидратирующимися ионами меди; образуются атомы меди, выделяющиеся в виде металла. Соответствующее электрохимическое уравнение имеет вид:
Си2+ + 2е~ = Си
Суммарное уравнение реакции, протекающей в элементе, получится при сложении уравнений обеих полуреакций. Таким образом, при работе гальванического элемента электроны от восстановителя переходят к окислителю по внешней цепи, на электродах идут электрохимические процессы, в растворе наблюдается направленное движение ионов.
Направление движения ионов в растворе обусловлено протекающими у электродов электрохимическими процессами. Как уже сказано, у цинкового электрода катионы выходят в раствор, создавая в нем избыточный положительный заряд, а у медного электрода раствор, наоборот, все время обедняется катионами, так что здесь раствор заряжается отрицательно. В результате этого создается электрическое поле, в котором катионы, находящиеся в растворе (Си2+ и Zn2+), движутся от цинкового электрода к медному, а анионы SO2-— в обратном направлении. В итоге жидкость у обоих электродов остается электронейтральной. Схема движения электронов и ионов при работе медно-цинкового элемента показана на рис. 83.
Электрод, на котором протекает окисление, называется анодом. Электрод, на котором протекает восстановление, называется катодом. В медно-цинковом элементе цинковый электрод является анодом, а медный — катодом.
2е
| ZnS04 |
Zn
-Zn*
2+ J w 2+
—Zn!—^j-Cu—i
Cu SO4
Рис. 82. Схема медно-цинкового гальванического элемента.
Рис. 83. Схема движения ионов и электронов при работе медно-цинкового гальванического элемента.
Протекающая в гальваническом элементе окислительно-восстановительная реакция представляет собой сложный процесс. Она включает собственно электрохимические стадии (превращения атомов, ионов или молекул на электродах), перенос электронов, перенос ионов. Все эти стадии сопряжены между собой и протекают с одной и той же скоростью; число электронов, которые за единицу времени отдает цинк, равно числу электронов, принимаемых за это же время ионами меди. Поэтому скорость реакции, протекающей в гальваническом элементе, пропорциональна количеству электричества, перенесенного по цепи в единицу времени, т. е. силе тока в цепи.
Электрический ток, протекающий по внешней цепи гальванического элемента, может производить полезную, работу. Но работа, которую можно выполнить за счет энергии химической реакции, зависит от ее скорости: она максимальна при бесконечно медленном— обратимом — проведении реакции (см. § 67). Следовательно, работа, которую можно произвести за счет реакции, протекающей в гальваническом элементе, зависит от величины отбираемого от него тока. Если, увеличивая сопротивление внешней цепи, уменьшать ток до бесконечно малого значения, то и скорость реакции в элементе тоже будет бесконечно малой, а работа —■ максимальной. Теплота, выделяемая во внутренней цепи элемента, будет при этом, наоборот, минимальна.
| * В расчетах будем пользоваться приближенным значением этой величины (96 500 Кл/моль). |
Работа электрического тока выражается произведением количества прошедшего по цепи электричества на напряжение. В мед-ио-цинковом элементе при окислении одного эквивалента цинка и Одновременном восстановлении одного эквивалента ионов меди по цепи пройдет количество электричества, численно равное одному фарадею (F = 96485 Кл/моль), так что полезная работа А', которую ток может совершить, будет равна
A'*=FV
где V — напряжение между полюсами элемента.
Но поскольку эта работа зависит от силы тока, то и напряжение между полюсами элемента тоже зависит от силы тока (F—■ величина постоянная). В предельном случае, отвечающем обратимому протеканию реакции, напряжение будет максимальным. Максимальное значение напряжения гальванического элемента, соответствующее обратимому протеканию реакции, называется электродвижущей силой (э.д.с.) данного элемента.
Для этого предельного случая полезная работа, производимая электрическим током в медно-цинковом элементе при взаимодействии одного эквивалента цинка с одним эквивалентом ионов меди, выразится уравнением
■^макс = ^макс e ЕЕ
где Е= VMSkc — э. д. с. элемента.
Ясно, что при взаимодействии одного моля атомов цинка с од-.' ним молем ионов меди уравнение примет вид:
В общем случае при растворении (или выделении) одного моля вещества, ионы которого имеют заряд, равный г, максимальная полезная работа связана с э. д. с. уравнением:
Лмакс = zFE
При постоянных температуре и давлении максимальная полезная работа реакции равна взятому с обратным знаком изменению энергии Гиббса AG (см. § 67). Отсюда:
AG — — zFE
Если концентрации (точнее говоря, активности) веществ, участвующих в реакции, равны единице, т. е. если соблюдаются стандартные условия, то э.д.с. элемента называется его стандартной электродвижущей силой и обозначается Е°. При этом последнее уравнение принимает вид:
Дс?° = - zFE°
Учитывая, что стандартное изменение энергии Гиббса реакции связано с ее константой равновесия (см. § 68) соотношением
AG° = -RT in К
получим уравнение, связывающее стандартную э. д. с. с константой равновесия реакции, протекающей в гальваническом элементе!
RT In К = zFE°
Измерения электродвижущих сил можно производить с высокой точностью. Эти измерения представляют собой один из наиболее точных методов определения стандартных энергий Гиббса, а следовательно, и констант равновесия окислительно-восстановительных реакций в растворах.
Окислительно-восстановительная реакция протекает в гальваническом элементе несмотря на то, что окислитель и восстановитель непосредственно друг с другом не соприкасаются. Для того.чтобы понять, как это происходит, как возникает электродвижущая сила при пространственном разделении процессов окисления и восстановления, рассмотрим более детально явления, происходящие на границах раздела фаз в гальваническом элементе.
Прямые опыты с применением радиоактивных индикаторов показывают, что если привести металл (М) в контакт с раствором его соли, то ионы металла (Мг+) переходят из металлической фазы в раствор и из раствора в металл. Поскольку энергетическое состояние ионов в этих фазах неодинаково, то в первый момент после установления контакта ионы металла переходят из металла в раствор и в обратном направлении с различной скоростью. Если преобладает переход ионов из металлической фазы в раствор, то раствор приобретает положительный заряд, а металлический электрод заряжается отрицательно. По мере увеличения этих зарядов переход катионов в одноименно заряженный раствор затрудняется, так что скорость этого процесса уменьшается, скорость же перехода катионов из раствора на отрицательно заряженный электрод возрастает. В результате скорости обоих процессов выравниваются и между металлом и раствором устанавливается равновесие:
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 543; Нарушение авторских прав?; Мы поможем в написании вашей работы!