
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Характеристика вагонов 81-717(714) 8 страница
|
|
|
|
М2+ (металл):?=fc Mz+ (раствор)
При этом металлический электрод оказывается заряженным отрицательно, а раствор — положительно. Если при установлении контакта металл — раствор скорость перехода катионов из металла в раствор была меньше, чем скорость их перехода в обратном направлении, то между электродом и раствором также устанавливается равновесие; но в этом случае электрод заряжается положительно, а раствор — отрицательно.
В.элементе Якоби — Даниэля соответствующие равновесия устанавливаются между цинковым электродом и раствором сульфата цинка
Zn2+ (металл) т-*- Zn2+ (раствор ZnS04) а также между медным электродом и раствором сульфата меди; Си2+ (металл) т~*" Cu2t (раствор CuS04)
В этом элементе имеются еще две границы раздела фаз: между растворами сульфатов цинка и меди, а также медью и цинком (см. рис. 82). Граница между растворами не оказывает существен-, ного влияния ни на величину э. д. е., ни на протекание реакции при работе элемента. Что же касается границы между металлами, то через нее могут проходить не ионы, как в случае границы металл— раствор, а электроны*. И здесь вследствие неодинакового энергетического состояния электронов в меди и в цинке первоначальные скорости перехода электронов из одного металла в другой и в обратном направлении различны. Однако и в этом случае быстро устанавливается равновесие, при котором металлы также приобретают заряды противоположного знака;
е- (медь) е~ (цинк)
Таким образом, при разомкнутой цепи на трех имеющихся в элементе Якоби — Даниэля границах раздела фаз устанавливаются равновесия, причем фазы заряжаются. В результате энергетическое состояние электронов на концах разомкнутой цеп» оказывается неодинаковым: на том медном проводнике, который соприкасается с цинковым электродом, энергия Гиббса электронов выше, а на том, который соединен с медным электродом, — ниже. Разность энергий Гиббса электронов на концах цепи и определяет; э.д.с. данного элемента.
При замыкании внешней цепи электроны перемещаются от цинкового электрода к медному. Поэтому равновесия на фазовых границах нарушаются; происходит направленный переход ионов цинка из металла в раствор, ионов меди — из раствора в металл, электронов— от цинка к меди: протекает окислительно-восстановительная реакция.
В принципе электрическую энергию может дать любая окислительно-восстановительная реакция. Однако число реакций, практически используемых в химических источниках электрической энергии, невелико. Это связано с тем, что не всякая окислительно-восстановительная реакция позволяет создать гальванический элемент, обладающий технически ценными свойствами (высокая и практически постоянная э.д.с, возможность отбирания больших токов, длительная сохранность и др.). Кроме того, многие окислительно-восстановительные реакции требуют расхода дорогостоящих веществ.
В отличие от медно-цинкового элемента, во всех современных гальванических элементах и аккумуляторах используют не два, а один электролит; такие источники тока значительно удобнее в эксплуатации. Например, в свинцовых аккумуляторах (см. § 189) электролитом служит раствор серной кислоты.
| * Диффузия атомов и ионов из металла в металл происходит много медленнее и практически не влияет на установление равновесия на границе между металлами. |
Почти во всех выпускаемых в настоящее время гальванических элементах анод изготовляется из цинка, а в качестве вещества для катода обычно применяются оксиды менее активных металлов. Описание важнейших гальванических элементов см. § 214, аккумуляторов—§§ 189, 201, 244.
Химические источники электрической энергии применяются в различных отраслях техники. В средствах связи (радио, телефон, телеграф) и в электроизмерительной аппаратуре они служат источниками электропитания, на автомобилях, самолетах, тракторах применяются для приведения в действие стартеров и других устройств, на транспорте, в переносных фонарях с их помощью производится освещение.
Все обычные ХИЭЭ ие свободны от двух недостатков. Во-первых, стоимость веществ, необходимых для их работы (например, свинца, кадмия), высока. Во-вторых, отношение количества энергии, которую может отдать элемент, к его массе мало. На протяжении последних десятилетий ведутся исследования, направленные на создание элементов, при работе которых расходовались бы дешевые вещества с малой плотностью, подобные жидкому или газообразному топливу (природный газ, керосин, водород и др.). Такие гальванические элементы называются топливными. Проблеме топливного элемента уделяется в настоящее время большое внимание и можно полагать, что в ближайшем будущем топливные элементы найдут широкое применение.
99. Электродные потенциалы. Каждая окислительно-восстановительная реакция слагается из полуреакций окисления и восстановления. Когда реакция протекает в гальваническом элементе или осуществляется путем электролиза, то каждая полуреакция протекает на соответствующем электроде; поэтому полуреакции называют также электродными процессами.
В § 98 было показано, что протекающей в гальваническом элементе окислительно-восстановительной реакции соответствует э.д.с. этого элемента Е, связанная с изменением энергии Гиббса AG реакции уравнением:
AG = — zFE
В соответствии с разделением окислительно-восстановительной реакции на две полуреакции, электродвижущие силы также принято представлять в виде разности двух величии, каждая из которых отвечает данной полуреакции. Эти величины называются электродными потенциалами.
Для медно-цинкового элемента реакция, протекающая при его работе
Zn + Cu2+ = Zn2+ + Си
разбивается на полуреакции:
Си2+ + 2е~ = Си; Zn = Zn2+ + 2е~
Соответственно э.д.с. этого элемента (Е) можно представить как разность электродных потенциалов один из которых
отвечает первой, а другой (&2) — второй из записанных полуреак-
ций; J
Е—&| — 3?2
При этом изменение энергии Гиббса AGU которое отвечает термодинамически обратимому восстановлению одного моля ионов меди, равно
Д(?1 = —
а изменение энергии Гиббса AG2, отвечающее термодинамически обратимому окислению одного моля атомов цинка, равно
Д02 = — 2F&2
В общем случае любому электродному процессу
Ох + zs- = Red
соответствует электродный потенциал <8 и изменение энергии Гиббса AG, равнее:
ДО = - zF%
Здесь Red и Ох — сокращения латинских слов, обозначающие восстановленную и окисленную формы веществ, участвующих в электродном процессе.
В дальнейшем, говоря об электродных процессах, мы будем записывать их уравнения в сторону восстановления (за исключением, конечно, тех случаев, когда речь будет идти именно об окислении).
В результате изучения потенциалов различных электродных процессов установлено, что их величины зависят от следующих трех факторов: 1) от природы веществ — участников электродного процесса, 2) от соотношения между концентрациями * этих веществ и 3) от температуры системы. Эта зависимость выражается уравнением:
2ЖТ [Ох] * = * +-iF-lBlRidT
| * Строго говоря, величина электродного потенциала зависит от соотношения не концентраций, а активностей (см. § 86) веществ; во всех рассматриваемых далее уравнениях вместо концентрации должна стоять активность. Но при невысоких концентрациях растворов погрешность, вносимая заменой активности на концентрацию, невелика, |
Здесь е?° — стандартный электродный потенциал данного процесса — константа, физический смысл которой рассмотрен ниже; R — газовая постоянная; F—абсолютная температура; z — число электронов, принимающих участие в процессе; F — постоянная Фарадея; [Ох] и [Red] «— произведения концентраций веществ, участвующих в процессе в окисленной (Ох) и в восстановленной (Red) формах.
Физический смысл величины <§° становится ясным при рассмотрении случая, когда концентрации (активности) всех веществ, участвующих в данном электродном процессе, равны единице. При этом условии второе слагаемое правой части уравнения обращается в нуль (lg 1=0) и уравнение принимает вид:
Концентрации (активности), равные единице, называются стандартными концентрациями (активностями). Поэтому и потенциал, отвечающий этому случаю, называется стандартным потенциалом. Итак, стандартный электродный потенциал — это потенциал данного электродного процесса при концентрациях (точнее говоря, активностях) всех участвующих в нем веществ, равных единице.
Таким образом, в уравнении электродного потенциала первое слагаемое ф°) учитывает влияние на его величину природы ве-
/ 2,3#Г, [Ох] \. „ т,
ществ, а второе (^ zF ■ lg -щщ-) — их концентрации. Кроме того,
оба члена изменяются с температурой.
Для обычной при электрохимических измерениях стандартной температуры (25°С = 298 К), при подстановке значений постоянных величин [i? = 8,31 Дж/(моль-К), ^ = 96 500 Кл/моль] уравнение принимает вид:
я *° ■ 2,3-8,31-298 [Ох] ^, 0,059 [Ох]
Для построения численной шкалы электродных потенциалов нужно потенциал какого-либо электродного процесса принять равным нулю. В качестве эталона для создания такой шкалы принят электродный процесс
2Н+ + 2е~ = н2
Изменение энергии Гиббса, связанное с протеканием этой полуреакции при стандартных условиях, принимается равным нулю. В соответствии с этим и стандартный потенциал данного электродного процесса принят равным нулю. Все электродные потенциалы, приводимые в настоящей книге, а также в большинстве других современных изданий, выражены по этой, так называемой водородной шкале.
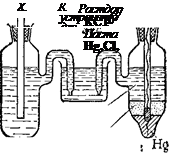
Приведенный выше электродный процесс осуществляется на водородном электроде. Последний представляет собой платиновую пластинку, электролитически покрытую губчатой платиной и погруженную в раствор кислоты, через который npony-i скается водород (рис. 84). Водород хорошо растворяется в платине; при этом молекулы водорода частично распадаются на атомы (пластина катализирует этот распад). На поверхности соприкосновения платины с раствором кислоты может протекать,
 | |||
 | |||
Рис. 85. Цепь для измерения электродного потенциала:
слева — электрод, потенциал которого нужно измерить; справа — каломельный электрод;
в середине — соединительный сосуд. _
окисление атомов или восстановление ионов водорода. Платина при этом практически не принимает участия в электродных реакциях и играет как бы роль губки, пропитанной атомарным водородом.
Потенциал водородного электрода воспроизводится с очень высокой точностью. Поэтому водородный электрод и принят в качестве эталона при создании шкалы электродных потенциалов.
Установим, какой вид принимает общее уравнение электродного потенциала для водородного электрода. В соответствии с уравнением электродного процесса (см. стр. 271) 2 = 2, [Ох] = = [Н+]2, [Red] = [H2]. Концентрация растворенного в платине водорода пропорциональна его парциальному давлению рн'.
[Н2] = kpHi
где k — постоянная при данной температуре величина. Включая ее в значение «Г°, получим:
& = &° + 0,059 lg [Н+] - 0,030 lg рИг
Обычно парциальное давление водорода рн поддерживается равным нормальному атмосферному давлению, которое условно принимается за единицу. В этом случае последний член полученного уравнения обращается в нуль (lg 1=0). Тогда
8 = &° + 0,059 lg [Н+]
Поскольку стандартный потенциал рассматриваемого процесса, принят равным нулю, то
<У = 0,059 lg [н+]
или, учитывая, что lg[H+] = —рН, окончательно получаем;
$ = — 0,059рН
Для определения потенциала того или иного электродного про» цесса нужно составить гальванический элемент из испытуемого и стандартного водородного электродов и измерить его э. д. с. Поскольку потенциал стандартного водородного электрода равен нулю, то измеренная э. д. с будет представлять собою потенциал данного электродного процесса.
Практически при измерениях потенциалов в качестве электро-да сравнения пользуются не стандартным водородным, а другими электродами, более удобными в обращении, потенциалы которых по отношению к стандартному водородному электроду известны. При этом необходимо рассчитать э. д. с. элемента согласно уравнению:
Е = | ё?ср — &Х, i
Здесь Е — э.д.с. элемента; е?ср — известный потенциал электрода сравнения; &х—потенциал испытуемого электрода. Решая уравнение относительно &х, получаем:
для &ср>&х &х = &ср — Е
для SCp<Sx &х = &с$ + Е
В качестве электродов сравнения чаще всего применяют хлор-серебряный и каломельный электроды. Хлорсеребряный электрод— это серебряная проволочка, покрытая слоем AgCl и погруженная в раствор соляной кислоты или ее соли. При замкнутой цепи на нем протекает реакция:
AgCl + е~ = Ag+ + СГ
Каломельный электрод представляет собой ртуть, покрытую взвесью каломели Hg2Cl2 в растворе КС1. Потенциалы этих электродов воспроизводятся с высокой точностью. На рис. 85 изображена цепь с каломельным электродом.
Для того чтобы найти значение электродного потенциала, необходимо измерить не напряжение работающего элемента, а именно его э. д. с. При измерениях э. д. с. сопротивление внешней цепи (т. е. измерительного устройства) очень велико. Реакция в элементе при этом практически не протекает. Таким образом, электродные потенциалы отвечают обратимому протеканию процессов или, что то же самое, состоянию электрохимического равновесия на электродах. Поэтому электродные потенциалы часто называют равновесными электродными потенциалами или просто равновесными потенциалами.
Рассмотрим теперь, какой вид принимает общее уравнение электродного потенциала в важнейших случаях.
1. Электродный процесс выражается уравнением
Мг+ + ге~ = М
где М обозначает атомы какого-либо металла, Мг+—его г-заряд-ные ионы.
К этому случаю относятся оба электрода медно-цинкового элемента и вообще любой металлический электрод в растворе соли этого же металла. Здесь окисленной формой металла являются его ионы, а восстановленной — атомы. Следовательно, [Ох] = [Мг+], a [Red] = const, так как концентрация атомов в металле при постоянной температуре — величина постоянная. Включая значение этой постоянной в величину &°, получим;
Например, для процесса Ag+ + e- = Ag В = 0,799 + 0,059 lg [Ag+]
а для процесса Zn2+ -f- 2е~ = Zn
Ш = — 0,763 + 0,030 lg [Zn2+J
2, Электродный процесс выражается уравнением:
M*2+ + (га - zi) е~ = М*1*
В этом случае и окисленная (мгг+) и восстановленная (Мг'+) формы металла находятся в растворе я чх концентрации —величины переменные. Поэтому
к_». 0,059 [Мг-+]
Например, для процесса Fe3+-f-е-= Fe2+:
| [Fe2+J |
[Fe3+]
S = 0,771 -j- 0,059 lg
В этом и в рассматриваемых ниже случаях электрод, на котором протекает электродный процесс, изготовляется из инертного материала. Чаще всего в качестве такого материала применяют платину.
Мы рассмотрели примеры, когда в электродных процессах принимали участие только ионы, состоящие из одного элемента. Однако часто окисляющееся или восстанавливающееся вещество состоит не из одного, а из двух или большего числа элементов. Чаще всего в составе окислителя содержится кислород; при этом в электродном процессе обычно принимают участие также вода и продукты ее диссоциации — ионы водорода (в кислой среде) или гидроксид-ионы (в щелочной среде). Рассмотрим, как будут выглядеть в таких случаях уравнения потенциалов электродных процессов.
3. Электродный процесс выражается уравнением;
02 + 4Н+ + 4е~ = 2Н20
Эта полуреакция (при протекании ее в сторону восстановления)' играет очень большую роль при коррозии металлов (см. § 196). Кислород — самый распространенный окислитель, вызывающий коррозию металлов в водных средах.
В рассматриваемом электродном процессе в результате восстановления кислорода, протекающего с участием ионов водорода, образуется вода. Следовательно, [Red] = [Н20]2, а [Ох] = = [02] [Н+]4. Концентрацию воды в разбавленных растворах можно считать постоянной. Концентрация кислорода в растворе пропорциональна его парциальному давлению над раствором ([02] == — kpo2). Выполнив необходимые преобразования и обозначив сумму постоянных величин через <§а, получим:
8 = g° + 0,059 lg [Н+] + lg р02
Для рассматриваемого процесса &° = 1,228 В; следовательно S = 1,228 — 0,059рН + 0,015 lg р02
При парциальном давлении кислорода, равном нормальному атмосферному давлению (которое условно принимается равным единице), lgpo2=0 и последнее уравнение принимает вид
& — 1,228 — 0,059рН
4. Для электродных процессов, записываемых более сложными уравнениями, в выражениях для потенциалов содержится большее число переменных концентраций. Рассмотрим, например, электродный процесс:
MnOJ + 8Н+ + 5е~ = Мп2+ + 4Н20
Эта полуреакция протекает (в сторону восстановления) при взаимодействии перманганата калия с большинством восстановителей в кислой среде.
Концентрации всех веществ, участвующих в рассматриваемом электродном процессе, кроме воды, — величины переменные. Для этого процесса <s?° = 1,507 В. Уравнение электродного потенциала имеет вид:
„ „„, 0,059, [МпО;]. 8 • 0,059 Гн+1
+__,„__ + ___ ig[H] =
= 1,507 + 0,012 lg - 0,095рН
Примеры 3 и 4 показывают, что в случае электрохимических процессов, протекающих с участием воды, концентрация ионов водорода входит в числитель логарифмического члена уравнения потенциала. Поэтому электродные потенциалы таких процессов зависят от рН раствора и имеют тем большую величину, чем кислее раствор.
Таблица 18. Электродные потенциалы в водных растворах при 25 °С и при парциальном давлении газов, равном нормальному атмосферному давлению
Электродный процесс
Уравнение электродного потенциала
Li+ + е- = Li Rb+ + e~ = Rb К+ + е- = К Cs+ + e- = Cs Са2+ + 2е- = Са Na+ + е- = Na Mg2+ + 2е- = Mg Н2 + 2е" = 2Н"
Al3t + Зе" = А1 Ti2+ + 2е- = Ti Мп2+ + 2е- = Мп Сг2+ + 2е- = Сг Zn2+ + 2е- = Zn Сг3+ + Зе- = Сг
[Au(CN)2]~ + е' = Au + 2CN"
2Н+ + 2е~ = Н2 Си2+ + 2е- = Си 12(к) + 2е~ = 2Г
MnOj + е~ = МпО2,"
Fe3+ + е- = Fe2+
NO J + 2H+ + e~ = N02(r) + H,0
Hg22+ + 2e" = 2Hg Ag+ + e- = Ag Hg2+ + 2e- = Hg
2Hg2+ + 2e" = Hgf
Вг2(ж) + 2e- = 2Br
Pt2+ + 2e- = Pt
02 + 4H+ + 4e~ = 2H20
<T = — 3,045 + 0,059 lg [Li+]
«Г = — 2,925 + 0,059 lg [Rb+]
В = - 2,925 + 0,059 lg [Ю]
В = - 2,923 + 0,059 lg [Cs+]
& = — 2,866 + 0,030 lg [Ca2+]
& = - 2,714 + 0,059 lg[Na+]
<T = - 2,363 + 0,030 lg [Mg2+]
В = - 2,251 + 0,059 lg [H"]
В = — 1,662 + 0,020 lg [Al3+]
B = - 1,628 + 0,030 lg [Ti2+]
& = — 1,180 + 0,030 lg [Mn2+]
В = - 0,913 + 0,030 lg [Cr2+]
B = — 0,763 + 0,030 lg [Zn2+]
В = -0,744 + 0,020 lg [Cr3+]
ж neixnnsai [[Au(CN)2]-l
В = — 0,61 + 0,059 lg rcN-j2---------
В = - 0,059 рН
cT = 0,337 + 0,030 lg [Cu2+]
В = 0,536 - 0,059 lg [Г]
В = 0,558 + 0,059 lg -Mn0«L
[MnOj-[Fe3+]
^ = 0,771 + 0,059 lgfp^
<T = 0,80 + 0,059 lg [NOjJ - 0,118 pH В = 0,788 + 0,030 lg [Hg2+] В = 0,799 + 0,059 lg [Ag+] В = 0,854 + 0,030 lg [Hg2+]
В = 0,920 + 0,030 lg V g 1
l"g2 J
<У= 1,065 — 0,059 lg[Br-] <T = 1,2 + 0,030 lg[Pt2+] <T= 1,229- 0,059 pH

Как уже сказано, зависимость электродного потенциала от природы веществ — участников электродного процесса учитывается величиной <0>°. В связи с этим все электродные процессы принято располагать в ряд по величине их стандартных потенциалов. В табл. 18 уравнения важнейших электродных процессов и соответствующие электродные потенциалы приведены в порядке возрастания величин В°.
Положение той или иной электрохимической системы в этом ряду характеризует ее окислительно-восстановительную способность. Под электрохимической системой здесь подразумевается совокупность всех веществ — участников данного электродного процесса.
Окислительно-восстановительная способность представляет собою понятие, характеризующее именно электрохимическую систему, но часто говорят и об окислительно-восстановительной способности того или иного вещества (или иона). При этом следует, однако, иметь в виду, что многие вещества могут окисляться или восстанавливаться до различных продуктов. Например, пер-манганат калия (ион МГ1О4) может в зависимости от условий, прежде всего от рН раствора, восстанавливаться либо до иона Мп2+, либо до Мп02, либо до иона МпО2,"-
Соответствующие электродные процессы выражаются уравнениями:, МпОГ + 8Н+ + 5е~ = Мп2+ + 4Н20 МпОГ + 4Н+ + Зе" = Мп02 + 2Н20 МпОГ + е~ = МпО2,"
Поскольку стандартные потенциалы этих трех электродных процессов различны (си. табл. 1S), то различно и пололсенне этих трех систем в ряду &°, Таким образом, один и тот же окислитель (MnOij) может занимать в ряду стандартных потенциалов несколько мест.
Элементы, проявляющие в своих соединениях только одну степень окисленности, имеют простые окислительно-восстановительные характеристики и занимают в ряду стандартных потенциалов мало мест. К их числу относятся в основном металлы главных подгрупп I—III групп периодической системы. Много же мест в ряду &° занимают те элементы, которые образуют соединения различных степеней окисленности — неметаллы и многие металлы побочных подгрупп периодической системы.
Ряд стандартных электродных потенциалов позволяет решать вопрос о направлении самопроизвольного протекания окислительно-восстановительных реакций. Как и в общем случае любой химической реакции, определяющим фактором служит здесь знак изменения энергии Гиббса реакции. Если из двух электрохимических систем составить гальванический элемент, то при его работе электроны будут самопроизвольно переходить от отрицательного полюса элемента к положительному, т. е. от электрохимической системы с более низким значением электродного потенциала к системе с более высоким его значением. Но это означает, что первая из этих систем будет выступать в качестве восстановителя, а вторая— в качестве окислителя. Следовательно, в гальваническом элементе окислительно-восстановительная реакция может самопроизвольно протекать в таком направлении, при котором электрохимическая система с более высоким значением электродного потенциала выступает в качестве окислителя, т. е. восстанавливается. При непосредственном взаимодействии веществ возможное направление реакции будет, конечно, таким же, как и при ее осуществлении в гальваническом элементе.
Если окислитель и восстановитель расположены далеко друг от друга в ряду <%°, то направление реакции практически полиостью определяется их взаимным положением в этом ряду. Например, цинк (8° = —0,763 В) будет вытеснять медь (3° = = +0,337 В) из водного раствора ее соли при любой практически осуществимой концентрации этого раствора. Если же величины 3'° для окислителя и восстановителя близки друг к другу, то при решении вопроса о направлении самопроизвольного протекания реакции необходимо учитывать влияние на электродные потенциалы также и концентраций соответствующих веществ. Например, реакция
Hg|+ -f 2Fe2+ = 2Hg + 2Fe3+
может самопроизвольно идти как слева направо, так и справа налево. Направление ее протекания определяется концентрациями ионов железа и ртути. В этой реакции участвуют две электрохимические системы:
Hgj+ + 2е- = 2Hg (1)
Fe3+ + е~ = Fe2+ (2)
1 Соответствующим электродным процессам отвечают потенциалы;
&1 = 0,788 + 0,030 lg [Hg2+] 82 = 0,771 + 0,059 lg-Щ}
Подсчитаем величины <$х и <$% при [Hg|+] = [Fe2+] = Ю-1 и [Fe3+] = 1G-4 моль/1000 г Н20:
%х = 0,788 + 0,030 lg 10~' = 0,788 - 0,030 = 0,76 В 8'г = 0,771 + 0,059 lg -~г- = 0,771 - 3 • 0,059 0,59 В
Таким образом, при взятом соотношении концентраций &\ > 82 и реакция протекает слева направо.
Теперь подсчитаем &\ и <S<i при обратном соотношении концен-
траций. Пусть Fe2+]=10~4, a [Fe3+] = 10_1 моль/1000 г
Н20
$х — 0,788 + 0,030 lg 10~4 = 0,788 - 4 • 0,030 0,67 В Ю-1
8ц = 0,771 + 0,059 lg —— = 0,771 + 3 • 0,059 s* 0,95 В 10
Следовательно, при этих концентрациях 82 ~> $\ и реакция протекает справа налево.
Если окислительно-восстановительная реакция протекает с участием воды и ионов водорода или гидроксид-ионов, то необходимо учитывать также величину рН среды.
В табл. 18 включено 39 полуреакций; комбинируя их друг о другом, можно решить вопрос о направлении самопроизвольного протекания 39-38/2 = 741 реакции.
Пример. Установить, направление возможного протекания реакции: 2KBr + РЬ02 + 4HN03 = Pb(N03)2 + Br2 + 2KN03 + 2Н20
Запишем уравнение реакции в ионно-молекулярной форме:
2Вг" + РЮ2 + 4Н+ = РЬ2+ + Вг2 + 2Н20
В табл. 18 находим стандартные электродные потенциалы электрохимических систем, участвующих в реакции:
Вг2 + 2е~~ = 2ВГ 8° = 1,065 В
РЮ2 + 4Н+ + 2е~ = РЬ2+ + 4Н20 8° = 1,455 В
Окислителем всегда служит электрохимическая система с более высоким значением электродного потенциала. Поскольку здесь 82 значительно больше, чем то практически при любых концентрациях взаимодействующих веществ бромид-ион будет служить восстановителем и окисляться диоксидом свинца: реакция будет самопроизвольно протекать слева направо.
Чем дальше находится та или иная система в ряду стандартных потенциалов, т. е. чем больше ее стандартный потенциал, тем
100. Ряд напряжений металлов
более сильным окислителем является ее окисленная форма. И, наоборот, чем раньше расположена система в ряду, т. е. чем меньше значение тем более сильный восстановитель ее восстановленная форма. Действительно, среди окисленных форм систем конца ряда мы находим такие сильные окислители, как F2, Н2Оо, МпСЧ • Самые же сильные восстановители — восстановленные формы систем начала ряда: щелочные и щелочноземельные металлы.
При протекании окислительно-восстановительных реакций концентрации исходных веществ падают, а продуктов реакции — возрастают. Это приводит к изменению величин потенциалов обеих полуреакций: электродный потенциал окислителя падает, а электродный потенциал восстановителя возрастает. Когда потенциалы обоих процессов становятся равными друг другу, реакция заканчивается—наступает состояние химического равновесия.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 475; Нарушение авторских прав?; Мы поможем в написании вашей работы!