
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Характеристика вагонов 81-717(714) 10 страница
|
|
|
|
Поляризацию можно осуществить включением электрода в цепь постоянного тока. Для этого необходимо составить электролитическую ячейку из электролита и двух электродов — изучаемого и вспомогательного. Включая ее в цепь постоянного тока, можно сделать изучаемый электрод катодом или (при обратном включе-. нии ячейки) анодом. Такой способ поляризации называется поляризацией от внешнего источника электрической энергии.
Рассмотрим простой пример поляризации. Пусть медный электрод находится в 0,1 т растворе CuS04, не содержащем никаких примесей, в том числе растворенного кислорода. Пока цепь не замкнута, потенциал электрода при 25°С будет иметь равновесное значение, равное
S = 0,337 + 0,030 lg Ю-1 а* 0,31В
а на границе металла с раствором установится электрохимическое равновесие:
Cu2+ + 2e- ^=fc Си
Подключим электрод к отрицательному полюсу источника тока — сделаем его катодом. Избыток электронов, который появится теперь на электроде, сдвинет потенциал электрода в отрицательную сторону и одновременно нарушит равновесие. Электроны будут притягивать катионы меди из раствора — пойдет процесс восстановления;
Сиг+ + 2е~ = Си
Если подключить электрод не к отрицательному, а к положительному полюсу источника тока — сделать его анодом, то вследствие удаления части электронов потенциал электрода сместится в положительную сторону и равневесие также нарушится. Но теперь на электроде будет протекать процесс окисления, так кай в ходе этого процесса высвобождаются электроны!
Си = Сцг+ + 2е~
Таким образом, поляризация электрода в отрицательную сторону связана с протеканием процесса восстановления, а поляризация в положительную сторону — с протеканием процесса окисления. Процесс восстановления иначе называют катодным процессом, а процесс окисления — анодным. В связи с этим поляризация в отрицательную сторону называется катодной поляризацией, ав положительную — анодной.
Другой способ поляризации электрода — это контакт его с электрохимической системой, электродный потенциал которой имеет более положительное или более отрицательное значение, чем потенциал рассматриваемого электрода.
Рассмотрим работу медно-цинкового гальванического элемента. При разомкнутой цепи как иа медном, так н на цинковом электродах устанавливаются электрохимические равновесия. Но электродные потенциалы, отвечающие этим равновесиям, различны. В случае 0,1 т растворов они равны:
^Cu'Cu2+ = 0,337 + °'03° lg 10-1 ~ 0,31 В <rZn/Zr]2+ = —0,763 + 0,030 lg Ю-1 а* —0,79 В
При замыкании цепи оба электрода оказывают друг на друга поляризующее действие: потенциал медного электрода под влиянием контакта с цинком сдвигается в отрицательную сторону, а потенциал цинкового электрода под влиянием контакта с медью — в положительную. Иначе говоря, медный электрод поляризуется катодно, а цинковый — анодно. Одновременно на обоих электродах нарушаются электрохимические равновесия и начинают протекать электрохимические процессы: катодный процесс на медном электроде и анодный — на цинковом:
Cu2+ + 2е~ = Cu; Zn = Zn2+ + 2е~
Поляризация электрода — необходимое условие протекания электродного процесса. Кроме того, от ее величины зависит скорость электродного процесса: чем сильнее поляризован электрод, тем с большей скоростью протекает на нем соответствующая полуреакция.
Кроме величины поляризации на скорость электродных процессов влияют некоторые другие факторы. Рассмотрим катодное восстановление ионов водорода. Если катод изготовлен из платины, то для выделения водорода с заданной скоростью необходима определенная величина катодной поляризации. При замене платинового электрода на серебряный (при неизменных прочих условиях) для получения водорода с прежней скоростью понадобится большая поляризация. При замене катода на свинцовый поляризация потребуется еще большая. Следовательно, различные металлы обладают различной каталитической активностью по отношению к процессу восстановления ионов водорода. Величина поляризации, необходимая для протекания данного электродного Процесса с определенной скоростью, называется перенапряжением данного электродного процесса. Таким образом, перенапряжение выделения водорода на различных металлах различно.
В табл. 20 приведены для 1 н. растворов величины катодной поляризации, которую необходимо осуществить на электроде для
выделения на нем водорода со скоростью 0,1 мл в минуту с 1 см2 рабочей поверхности электрода.
Таблица 20. Перенапряжение выделения водорода иа различных металлах
| Металл электрода | Электролит | Перенапряжение выделения водорода, В | Металл электрода | Электролит | Перенапряжение выделения водорода, В |
| Железо | НС1 | 0,5 | Цинк | H2S04 | 1,0 |
| Медь | H2S04 | 0,6 | Ртуть | H2S04 | 1,2 |
| Серебро | HCl | 0,7 | Свинец | H2S04 | 1,3 |
Выяснение связи между величиной поляризации и скоростью электродного процесса является важнейшим методом изучения электрохимических процессов. При этом результаты измерений обычно представляют в виде поляризационных кривых — кривых зависимости плотности тока на электроде от величины поляризации. Вид поляризационной кривой того или иного электродного процесса отражает особенности его протекания. Методом поляризационных кривых изучают кинетику и механизм окислительно-восстановительных реакций, работу гальванических элементов, явления коррозии и пассивности металлов, различные случаи электролиза.
Большой вклад в развитие кинетики электродных процессов и теории перенапряжения внес советский ученый А. Н Фрумкии *,
Глаза ДИСПЕРСНЫЕ СИСТЕМЫ.
X КОЛЛОИДЫ
105. Дисперсное состояние вещества. Дисперсные системы. Кристаллы любого вещества, например сахара или хлорида натрия, можно получить разного размера — крупные и мелкие. Каков бы ни был размер кристаллов, все они имеют одинаковую для данного вещества внутреннюю структуру — молекулярную или ионную кристаллическую решетку.
| * Александр Наумович Фрумкин (1895—1976)—крупнейший со-ветский электрохимик, академик, лауреат Ленинской и Государственной премий. Разработал количественную теорию влияния электрического поля на адсорбцию молекул, развил учение о строении границы металл — раствор, внес значительный вклад в теорию э. д. с. гальванического элемента. |
При растворении в воде кристаллов сахара и хлорида натрия образуются соответственно молекулярные и ионные растворы. Таким образом, одно и то же вещество может находиться в различной степени раздробленности: макроскопически видимые частицы (>0,2—0,1 мм, разрешающая способность глаза), микроско-
|
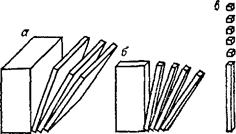
Рис. 87. Одно-, двух- и трехмерное диспергирование вещества приводит к образованию пленочно-(а), волокнисто-^) и корпускулярнодисперс-ных (в) систем.
пически видимые частицы (от 0,2—0,1 мм до 400— 300 нм *, разрешающая способность микроскопа при освещении белым светом) и отдельные молекулы (или ионы).
Постепенно складывались представления о том, что между миром молекул и микроскопически видимых частиц находится область раздробленности вещества с комплексом новых свойств, присущих этой форме организации вещества.
Представим себе кубик какого-либо вещества, который будем разрезать параллельно одной из его плоскостей, затем полученные пластинки начнем нарезать на палочки, а последние — на кубики (рис. 87). В результате такого диспергирования (дробления) вещества получаются пленочио-, волокнисто- и корпускулярнодис-персные (раздробленные) системы. Если толщина пленок, поперечник волокон или частиц (корпускул) меньше разрешающей способности оптического микроскопа, то они не могут быть обнаружены с его помощью. Такие невидимые в оптический микроскоп частицы называют коллоидными, а раздробленное (диспергированное) состояние веществ с размером частиц от 400—300 нм до1нм — коллоидным состоянием вещества.
Дисперсные (раздробленные) системы являются гетерогенными. Они состоят из сплошной непрерывной фазы —-дисперсионной среды и находящихся в этой среде раздробленных частиц того или иного размера и формы — дисперсной фазы.
| * В этой главе мы будем иметь дело с миром малых величин. Напомним, что в системе СИ: 1 м (метр) = 102 см (сантиметра) = 103 мм (миллиметра) = = 106 мкм (микрометра) = 109 нм (нанометра). Другие часто применяемые единицы — мк (микрон) и ммк (миллимикрон), причем: 1 см = 10 мм=104мк=, = 107 ммк. Таким образом: 1 им = Ю-6 м = Ю-7 см = 1 ммк; 1 мкм = Ю-6 м => = Ю-4 см = 1 мк. |
Поскольку дисперсная (прерывная) фаза находится в виде отдельных небольших частиц, то дисперсные системы, в отличие от гетерогенных со сплошными фазами, называют микрогетерогенными, а коллоиднодисперсные системы называют также ультра-микрогетерогенными, чтобы подчеркнуть, что в этих системах граница раздела фаз не может быть обнаружена,в световом микроскопе.
Когда вещество находится в окружающей среде в виде молекул или ионов, то такие растворы называют истинными, т. е. гомогенными однофазными растворами.
Обязательным условием получения дисперсных систем является взаимная нерастворимость диспергируемого вещества и дисперсионной среды. Например, нельзя получить коллоидные растворы сахара или хлорида натрия в воде, но они могут быть получены в керосине или в бензоле, в которых эти вещества практически нерастворимы.
Дисперсные системы классифицируют по дисперсности, агрегатному состоянию дисперсной фазы и дисперсионной среды, интенсивности взаимодействия между ними, отсутствию пли образованию структур в дисперсных системах.
Количественной характеристикой дисперсности (раздробленности) вешества является степень дисперсности (степень раздробленности, D) — величина, обратная размеру (а) дисперсных частиц:

З.;есь а равно либо диаметру сферических или волокнистых частиц, либо длине ребра кубических частиц, либо толщине пленок.
Степень дисперсности численно равна числу частиц, которые можно плотно уложить в ряд (или в стопку пленок) на протяжении одного сантиметра. В табл. 21 приведены условно принятые границы размеров частиц систем с различной раздробленностью вещества.
Таблица 21. Классификация корпускулярнодисперсных систем по степени дисперсности
| Системы | Раздробленность вещества | Поперечник частиц, см | Степень дисперсности D, см-1 | Число атомов в одной частице |
| Грубодисперспые | Макроскопиче- | 1-Ю-2 | 1-Ю2 | > 10" |
| ская Микроскопиче- | ю-2— 10~Е | 102—105 | > 108 | |
| Предельно-высоко- | кая Коллоидная | ю-5—ю-7 | 105 — 1 о7 | 109-103 |
| дисперсные Молекулярные и ион- | Молекулярная и | Ю-7-10-8 | > ю7 | < 103 |
| ные | иомная |
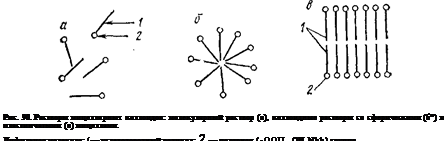
Если все частицы дисперсной фазы имеют одинаковые размеры, то такие системы называют монодисперсными (рис. 88, а и б). Частицы дисперсной фазы неодинакового размера образуют пол и дисперсные системы (рис. 88, в),
С повышением дисперсности все большее и большее число атомов вещества находится в поверхностном слое, на границе раздела фаз, по сравнению с их числом внутри объема частиц дисперсной фазы. Соотношение между поверхностью и объемом характеризует удельная поверхность: Sys. = S/V, которая для частиц сферической формы равна
Sya = 4яг2/(4/3яг3) = 3/г = 6/d
а для частиц кубической формы
Sya = б/2//3 = в/1
где г — радиус шара; d— его диаметр; / — длина ребра куба.
Так, удельная поверхность вещества, раздробленного до микронных кубиков, составляет 6 • 104 см-1. При этом из 1 см3 образуется 1012 микронных кубнков с суммарной поверхностью (S = *=5УД'У), равной 6-Ю4 см2 (6 м2). При дальнейшем дроблении 1 см3 вещества до кубиков коллоидной дисперсности, например С длиной ребра /= 10~в см (10 нм), их число достигает 1018 частиц, суммарная поверхность — 6-Ю6 см2 (600 м2), а удельная поверхность — 6- 10е см-1.
Следовательно, с повышением дисперсности вещества все большее значение имеют его свойства, определяемые поверхностными явлениями, т. е. совокупностью процессов, происходящих в межфазовой поверхности. Таким образом, своеобразие дисперсных систем определяется большой удельной поверхностью дисперсной фазы и физико-химическим взаимодействием дисперсной фазы и дисперсионной среды на границе раздела фаз.
Многообразие дисперсных систем обусловлено тем, что образующие их фазы могут находиться в любом из трех агрегатных Состояний. При схематической записи агрегатного состояния дисперсных систем первым указывают буквами Г (газ), Ж (жидкость) или Т (твердое) агрегатное состояние дисперсионной среды, затем ставят тире и записывают агрегатное состояние дисперсной фазы.
Дисперсные системы с газообразной дисперсионной средой называют аэрозолями. Туманы представляют собой аэрозоли С жидкой дисперсной фазой (Г4 •—Жг), а пыль и дым — аэрозоли с твердой дисперсной фазой (П — Т2); пыль образуется при диспергировании веществ, а дым — прн конденсации летучих веществ.
Пены — это дисперсия газа в жидкости (Ж1 — Г2), причем в пенах жидкость вырождается до тонких пленок, разделяющих отдельные пузырьки газа. Эмульсиями называют дисперсные системы, в которых одна жидкость раздроблена в другой, нерас-творяющей ее жидкости (Ж1 — Жг). Низкодисперсные системы твердых частиц в жидкостях (Ж1 — Т2) называют суспензиями, или взвесями, а предельно-высокодисперсные — ко л л о-
Свободно дисперсные
Рис. S! стены:
корпускулярно- (а — в), волокнисто- (г)'и пленочно-дисперсные (д); а, 6 — моноднсперсные; в — полидисперсная система.
о -°
о о О о ол о о
О о
°о °
, ^ о
и д н ы м и растворами, или золями*, часто лиозолями, чтобы подчеркнуть, что дисперсионной средой является жидкость (от греч. «лиос» — жидкость). Если дисперсионной средой является вода, то такие золи называют гидрозолями, а если органическая жидкость — органозолями.
В твердой дисперсионной среде могут быть диспергированы газы, жидкости или твердые тела. К. системам Ti — Г2 (твердые пены) относятся пенопласты, пенобетон, пемза, шлак, металлы с включением газов. Как своеобразные твердые пеиы можно рассматривать и хлебобулочные изделия. В твердых пенах газ находится в виде отдельных замкнутых ячеек, разделенных дисперсионной средой. Примером системы Т — Ж2 является натуральный жемчуг, представляющий собой карбонат кальция, в котором коллоидно-диспергирована вода.
Большое практическое значение имеют дисперсные системы типа Ti — Т2. К ним относятся важнейшие строительные материалы (например, бетон), а также металлокерамические композиции (керметы, стр. 639) и ситаллы (стр. 500).
К дисперсным системам типа Ti—Т2 относятся также некоторые сплавы, цветные стекла, эмали, ряд минералов, в частности некоторые драгоценные и полудрагоценные камни, многие изверженные горные породы, в которых при застывании магмы выделились кристаллы.
Цветные стекла образуются в результате диспергирования в силикатном стекле примесей металлов или их оксидов, придающих стеклу окраску. Например, рубиновое стекло содержит 0,01—0,1 % золота с размером частиц 4—30 мкм. Условия получения ярко-красных рубиновых и других окрашенных стекол изучались еще М. В. Ломоносовым. Эмали — это силикатные стекла с включениями пигментов (Sn02, Ti02, Zr02), придающих эмалям непрозрачность и окраску. Драгоценные и полудрагоценные камни часто представляют собой оксиды металлов, диспергированные в глиноземе или кварце (например, рубин — это Сг203, диспергированный в А1203).
| * Термин золь происходит от латинского «solutio», что означает раствор, и был введен тогда, когда еще не было установлено коренное отличие коллоидных растворов как гетерогенных систем от истинных растворов. |
Дисперсные системы могут быть свободнодисперсными (рис. 88) и связнодисперсными (рис. 89, а — в) в зависимости от отсутствия или наличия взаимодействия между частицами дисперсной фазы. К свободнодисперсным системам относятся аэрозоли, лиозоли, разбавленные суспензии и эмульсии. Они текучи. В этих системах частицы дисперсной фазы не имеют контактов, участвуют в беспорядочном тепловом движении, свободно перемещаются под действием силы тяжести. Связнодисперсные системы— твердообразны; они возникают при контакте частиц дисперсной фазы, приводящем к образованию структуры в виде каркаса или сетки. Такая структура ограничивает текучесть дисперсной системы и придает ей способность сохранять форму. Подобные структурированные коллоидные системы называют гелями.

Рис. 89. Связнодисперсные (а — в) и капиллярнодисперсные (г, д) системы:
гель (а), коагулят с плотной (6) и рыхлой — «арочной» (в) структурой.
Переход золя в гель, происходящий в результате понижения устойчивости золя, называют гелеобразовапием (или желатинированием). Сильно вытянутая и пленочно-листочко-вая форма дисперсных частиц повышает вероятность контактов между ними и благоприятствует образованию гелей при малой концентрации дисперсной фазы. Порошки, концентрированные эмульсии и суспензии (пасты), пены — примеры связнодисперсных систем. Почва, образовавшаяся в результате контакта и уплотнения дисперсных частиц почвенных минералов и гумусовых (органических) веществ, также представляет собой связиодисперсную систему.
Сплошную массу вещества могут пронизывать поры и капилляры, образующие капиллярнодисперсные системы (рис. 89, г, д). К ним относятся, например, древесина, разнообразные мембраны и диафрагмы, кожа, бумага, картон, ткани.
106. Состояние вещества на границе раздела фаз. Все жидкости и твердые тела ограничены внешней поверхностью, на которой они соприкасаются с фазами другого состава и структуры, например, С паром, другой жидкостью или твердым телом. Свойства вещества в этой межфазиой поверхности, толщиной в несколько поперечников атомов или молекул, отличаются от свойств внутри объема фазы. Внутри объема чистого вещества в твердом, жидком или Газообразном состоянии любая молекула окружена себе подобными молекулами. В пограничном слое молекулы находятся во взаимодействии или с разным числом молекул (например, на границе жидкости или твердого тела с их паром), или с молекулами различной химической природы (например, иа границе двух взаимно малорастворимых жидкостей). Чем больше различие в напряженности межмолекулярных сил, действующих в каждой из фаз, тем больше потенциальная энергия межфазовой поверхности, кратко называемая поверхностной энергией.
Работу, затрачиваемую на изотермическое и обратимое образование единицы новой поверхности раздела фаз и равную изменению энергии Гиббса в соответствующем процессе (см. § 67), называют удельной свободной поверхностной энергией (а). В случае границы двух конденсированных фаз эту величину называют пограничным, а для границы жидкости с ее парами — поверхностным натяжением.
Поверхностное и пограничное натяжение выражаются в единицах работы, деленных на единицы площади (напомним, что 1 эрг = 1 дин-см = Ю-7 Дж; 1 м2 — 104 см2):
1 эрг/см2 = 10~3 Дж/м2 = 1 дин/см
Значение о зависит от природы соприкасающихся фаз, температуры и добавок растворенных веществ.
Для большинства чистых жидкостей на границе с воздухом, насыщенным их парами (малополярной средой) поверхностное натяжение находится в пределах 1—5 -10-2 Дж/м2, а для сильно полярной жидкости — воды — прн 20 °С а = 7,275-Ю-2 Дж/м2. С повышением температуры величина а уменьшается (ослабление межмолекулярного взаимодействия), и при критической температуре, когда исчезает граница между жидкостью и паром, а = 0.
Для расплавленных солей прн 400—1000 °С а «0,15 Дж/м2. Для ртути при комнатной температуре а «0,48 Дж/м2. Для других металлов в расплавленном состоянии а достигает 1 Дж/м2 и более.
Все самопроизвольные процессы происходят в направлении уменьшения энергии Гиббса (см. § 67). Аналогично иа границе раздела фаз самопроизвольно происходят процессы в направлении уменьшения свободной поверхностной энергии, равной произведению ее удельного значения (о) на площадь поверхности (S). Во всех системах произведение aS стремится к минимальному значению, возможному для данной системы при сохранении постоянства се объема. Вследствие этого дисперсные системы принципиально термодинамически неустойчивы.
Если о постоянно, то самопроизвольно происходят процессы в направлении уменьшения суммарной поверхности (S), приводящие к уменьшению дисперсности, т. е. к укрупнению частиц. Поэтому происходит слияние мелких капель в туманах, дождевых облаках и эмульсиях, агрегация высокодисперсных частиц в более крупные образования. Все это приводит к разрушению дисперсных систем: туманы и дождевые облака проливаются дождем, эмульсии расслаиваются, коллоидные растворы коагулируют, т.е. разделяются на осадок дисперсной фазы (коагулят, рис. 89, б, б) и дисперсионную среду, или, в случае вытянутых частиц дисперсной фазы, превращаются в гель (рис. 89, а).
Способность раздробленных систем сохранять присущую им степень дисперсности называется агрегативной устойчивостью. Агрегативная неустойчивость коллоидного состояния вещества отличает его от агрегативно устойчивых грубодисперсных и молекулярных систем. Агрегативной неустойчивостью коллоидного состояния вещества обусловливается изменчивость коллоидных систем как во времени, так и под влиянием добавок разнообразных веществ *.
| * В учение об агрегативной неустойчивости как качественной особенности коллоидного состояния вещества и в развитие представлений о стабилизаторах дисперсности большой вклад внес Николай Петрович Песков (1880—■ 1940)—профессор Московского химико-технологического института имени Д. И. Менделеева, |
Если в той или иной системе величина поверхности не может изменяться, то самопроизвольное убывание произведения oS осуществляется путем уменьшения о на границе раздела фаз. Это является причиной адсорбционных процессов (см. § 109), состоящих в изменении концентрации и состава веществ на границе раздела фаз. Общая направленность самопроизвольных процессов к уменьшению свободной поверхностной энергии не только является причиной лабильности высокодисперсных систем, но и открывает путь стабилизации дисперсности путем изменения межфазовых поверхностей (см. § ИЗ).
Высокодисперсное состояние вещества — качественно особая форма его существования. Поэтому область естествознания, изучающая объективные физические и химические закономерности поверхностных явлений и гетерогенных высокодисперсных систем, сформировалась в самостоятельную научную дисциплину, называемую коллоидной химией.
107. Коллоиды и коллоидные растворы. Частицы коллоидных размеров могут иметь различную внутреннюю структуру, что существенно сказывается как на методах получения коллоидных растворов, так и на их свойствах. Существуют следующие три типа внутренней структуры первичных частиц коллоидных размеров.
I тип — суспензоиды (или необратимые коллоиды, лиофобные коллоиды). Так называют коллоидные растворы металлов, их оксидов, гидроксидов, сульфидов и других солей. Первичные частицы дисперсной фазы коллоидных растворов этих веществ по своей внутренней структуре не отличаются от структуры соответствующего компактного вещества и имеют молекулярную или ионную кристаллическую решетку. Суспензоиды — типичные гетерогенные высокодисперсные системы, свойства которых определяются очень сильно развитой межфазной поверхностью. От суспензий они отличаются более высокой дисперсностью. Суспен-зоидами их назвали потому, что, как и суспензии, они не могут длительно существовать в отсутствие стабилизатора дисперсности. Необратимыми их называют потому, что осадки, остающиеся при выпаривании таких коллоидных растворов, не образуют вновь золя при контакте с дисперсионной средой. Лиофобными (греч. «лиос» — жидкость, «фобио» — ненавижу) их назвали, предполагая, что особые свойства коллоидных растворов этого типа обусловлены очень слабым взаимодействием дисперсной фазы и дисперсионной среды. Концентрация лиофобных золей невелика, обычно меньше 0,1 %• Вязкость таких золей незначительно отличается от вязкости дисперсионной среды.
Лиофобные золи, как вообще дисперсные системы, в соответствии с их промежуточным положением между миром молекул и крупных тел, могут быть получены двумя путями: методами диспергирования, т. е. измельчения крупных тел, и методами конденсации молекулярно- или ионнорастворенных веществ. Измельчение путем дробления, помола, истирания дает сравнительно крупно-дисперсные порошки (<60 мкм). Более тонкого измельчения до-
107. Коллоиды и коллоидные растворы
стнгают с помощью специальных аппаратов, получивших название коллоидных мельниц, или применяя ультразвук.
Метод конденсации состоит в получении нерастворимых соединений путем реакций обмена, гидролиза, восстановления, окисления. Проводя эти реакции в сильно разбавленных растворах и в присутствии небольшого избытка одного из компонентов, получают не осадки, а коллоидные растворы. К конденсационным методам относится также получение лнозолей путем замены растворителя. Например, коллоидный раствор канифоли можно получить, выливая ее спиртовой раствор в воду, в которой канифоль нерастворима.
Как было выяснено ранее (§ 106), чем выше дисперсность, тем больше свободная поверхностная энергия, тем больше склонность к самопроизвольному уменьшению дисперсности. Поэтому для получения устойчивых, т. е. длительно сохраняющихся, суспензий, эмульсий, коллоидных растворов необходимо не только достигнуть заданной дисперсности, но и создать условия для ее стабилизации. Ввиду этого устойчивые дисперсные системы состоят не менее чем из трех компонентов: дисперсионной среды, дисперсной фазы и третьего компонента — стабилизатора дисперсной системы.
Стабилизатор может иметь как ионную, так и молекулярную, часто высокомолекулярную, природу. Ионная стабилизация золей лиофобных коллоидов связана с присутствием малых концентраций электролитов, создающих ионные пограничные слои между дисперсной фазой и дисперсионной средой (см. § 112 и 113).
Высокомолекулярные соединения (белки, полипептиды, полир--ниловый спирт и другие), добавляемые для стабилизации дисперсных систем, называют защитными коллоидами. Адсорби-руясь на границе раздела фаз, они образуют в поверхностном слое сетчатые и гелеобразиые структуры, создающие структурно-механический барьер, который препятствует объединению частиц дисперсной фазы. Структурно-механическая стабилизация имеет решающее значение для стабилизации вззесей, пает, пен, концентрированных эмульсий.
II тип — ассоциативные, или мицелл я рные, коллоиды. Их называют также полуколлоидами. Коллоиднодисперс-ные частицы этого типа возникают при достаточной концентрации дифильных * молекул низкомолекулярных веществ путем их ассоциации в агрегаты молекул — мицеллы — сферической или пластинчатой формы (рис. 90):
| * Дифильными называют молекулы, которые состоят из углеводородного радикала, имеющего сродство к неполярным растворителям, и гидрофильной (полярной) группы, имеющей сродство к воде. |
Молекулярный, истинный растЕОр Мицалляриый коллоидный раствор (золь)
Мицеллы представляют собой скопления правильно расположенных молекул, удерживаемых преимущественно дисперсионными силами.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 411; Нарушение авторских прав?; Мы поможем в написании вашей работы!