
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Характеристика вагонов 81-717(714) 14 страница
|
|
|
|
Пероксид водорода образуется в качестве промежуточного продукта при горении водорода, но ввиду высокой температуры
Рис. 106. Схема строения молекулы н..02.
н / Угол 9 близок^ к 100°, угол ф —к 95°. Длины связей: О —Н
/ о—Л Г 0,097 нм, О — О 0,149 им
водородного пламени тотчас же разлагается на воду и кислород. Однако если направить водородное пламя на кусок льда, то в образующейся воде можно обнаружить следы пероксида водорода.
Пероксид водорода получается также при действии атомарного водорода на кислород.
В промышленности пероксид водорода получают в основном электрохимическими методами, например анодным окислением растворов серной кислоты или гидросульфата аммония с последующим гидролизом образующейся при этом пероксодвусерной кислоты H2S208 (см. § 132). Происходящие при этом процессы можно изобразить схемой:
2H2S04 = H2S208 + 2Н+ + 2е" H2S208 + 2Н20 = 2H2S04 + Н202
В пероксиде водорода атомы водорода ковалентно связаны с атомами кислорода, между которыми также осуществляется простая связь. Строение пероксида водорода можно выразить следующей структурной формулой: Н—О—О—Н.
Молекулы Н202 обладают значительной полярностью (ц = = 2,13D), что является следствием их пространственной структуры (рис. 106).
В молекуле пероксида водорода связи между атомами водорода и кислорода полярны (вследствие смещения общих электронов в сторону кислорода). Поэтому в водном растворе под влиянием полярных молекул воды пероксид водорода может отщеплять ионы водорода, т. е. он обладает кислотными свойствами. Пероксид водорода— очень слабая двухосновная кислота (К\ = 2,6-Ю-12); в водном растворе он распадается, хотя и в незначительной степени, на ионы:
Н202 ч=*= Н+ + Н02
Диссоциация по второй ступени
НО" ч=*= Н+ + о*"
практически не протекает. Она подавляется присутствием воды — вещества, диссоциирующего с образованием ионов водорода в большей степени, чем пероксид водорода. Однако при связывании ионов водорода (например, при введении в раствор щелочи) диссоциация по второй ступени происходит.
С некоторыми основаниями пероксид водорода реагирует непосредственно, образуя соли. Так, при действии пероксида водорода на водный раствор гидроксида бария выпадает осадок бал
риевой соли пероксида водорода;
Ва(ОН)2 + Н202 = ВаО^ + 2Н20
Соли пероксида водорода называются пероксидами или перекисями. Они состоят из положительно заряженных ионов металла и отрицательно заряженных ионов Of", электронное строение которых можно изобразить схемой:
sO:sO:
Степень окисленности кислорода в пероксиде водорода равна — 1, т. е. имеет промежуточное значение между степенью окисленности кислорода в воде (—2) и в молекулярном кислороде (0)'. Поэтому пероксид водорода обладает свойствами как окислителя, так и восстановителя, т. е. проявляет окислительно-восстановительную двойственность. Все же для него более характерны окислительные свойства, так как стандартный потенциал электрохимической системы
Н202 + 2Н+ + 2е~ = 2Н20
в которой Н202 выступает как окислитель, равен 1,776 В, в то время как стандартный потенциал электрохимической системы
02 + 2Н+ + 2е" = Н202
в которой пероксид водорода является восстановителем, равен 0,682 В. Иначе говоря, пероксид водорода может окислять вещества, <§° которых не превышает 1,776 В, а восстанавливать только те, %° которых больше 0,682 В. По табл. 18 (на стр. 277) можно видеть, что в первую группу входит гораздо больше веществ.
В качестве примеров реакций, в которых Н202 служит окислителем, можно привести окисление нитрита калия
KN02 + Н202 = KN03 + Н20 и выделение иода из иодида калия:
2KI + Н202 = 12 + 2КОН
Как пример восстановительной способности пероксида водорода укажем на реакции взаимодействия Н202 с оксидом серебра(I)
Ag20 + Н202 = 2Ag + Н20 + 02 а также с раствором перманганата калия в кислой среде:
2КМп04 + 5Н202 + 3H2S04 = 2MnS04 + 502 + K2S04 + 8Н20
Если сложить уравнения, отвечающие восстановлению пероксида водорода и его окислению, то получится уравнение самоокисления-самовосстановления пероксида водорода:
, Н202 + 2Н+ + 2е" = 2Н20
___________ Н202 = 02 + 2Н+ + 2е~
211*0» = 2НаО + Оа
Это — уравнение процесса разложения пероксида водорода, о котором говорилось выше.
Применение пероксида водорода связано с его окислительной способностью и с безвредностью продукта его восстановления (Н20). Его используют для отбелки тканей и мехов, применяют в медицине (3% раствор — дезинфицирующее средство), в пище» вой промышленности (при консервировании пищевых продуктов)", в сельском хозяйстве для протравливания семян, а также в производстве ряда органических соединений, полимеров, пористых материалов. Как сильный окислитель пероксид водорода используется в ракетной технике.
Пероксид водорода применяют также для обновления старых картин, написанных масляными красками и потемневших от времени вследствие превращения свинцовых белил в черный сульфид свинца под действием содержащихся в воздухе следов сероводорода. При промывании таких картин пероксидом водорода сульфид свинца окисляется в белый сульфат свинца:
PbS + 4Н202 = PbS04 + 4НгО
Глава ГАЛОГЕНЫ XII
Входящие в главную подгруппу VII группы элементы фтор (Fluorum), хлор (Chlorum), бром (Bromum), иод (Jodum) и астат (Astatine) называются галогенами. Это название, которое буквально означает «солерождающие», элементы получили за способность взаимодействовать с металлами с образованием типичных солей, например хлорида натрия NaCl.
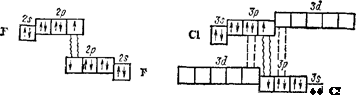
Во внешнем электронном слое атомы галогенов содержат семь
электронов — два на s- и пять на р-орбиталях (ns2np5). Галогены
обладают значительным сродством к электрону (табл. 23) — их
атомы легко присоединяют электрон, образуя однозарядные отри-
цательные ионы, обладающие электронной структурой соответ-,
ствующего благородного газа (ns2np6). Склонность к присоедине-
нию электронов характеризует галогены как типичные неметаллы.
Аналогичное строение наружного электронного слоя обусловливает
большое сходство галогенов друг с другом, проявляющееся как в
их химических свойствах, так и в типах и свойствах образуемых
ими соединений. Но, как показывает сопоставление свойств гало-,
генов, между ними имеются и существенные различия. *
В табл. 23 приведены некоторые свойства атомов галогенов и
образуемых ими простых веществ. <
С повышением порядкового номера элементов в ряду F—А8 увеличиваются радиусы атомов, уменьшается электроотрицатель\

числа электронов, принимающих участие в образовании ковалент-ных связей, до 3, 5 или 7 (см. схему на стр. 123).
118. Галогены в природе. Физические свойства галогенов. Галогены, вследствие их большой химической активности, находятся в природе исключительно в связанном состоянии — главным образом в виде солей галогеноводородных кислот.
Фтор встречается в природе чаще всего в виде минерала пла.' викового шпата CaF2, получившего это название потому, что его прибавление к железным рудам приводит к образованию легкоплавких шлаков при выплавке чугуна. Фтор содержится также в минералах криолите Na3AlF6 и фторапатите Ca5F(P04b.
Важнейшим природным соединением хлора является хлорид натрия (поваренная соль) NaCl, который служит основным сырьем для получения других соединений хлора. Главная масса хлорида натрия находится в воде морей и океанов. Воды многих озер также содержат значительное количество NaCl — таковы, например, в СССР озера Эльтон и Баскунчак. Хлорид натрия встречается так-же и в твердом виде, образуя местами в земной коре мощные пласты так называемой каменной соли. В природе распространены и другие соединения хлора, например хлорид калия в виде минералов карналлита KCl-MgCl2-6H20 и сильвина КО.
Хлор под давлением около 0,6 МПа уже при комнатной температуре превращается в жидкость. Сжиженный хлор обычно хранят и транспортируют в стальных баллонах или цистернах.
Подобно хлору бром находится в природе преимущественно в виде солей калия, натрия и магния. Бромиды металлов содержатся в морской воде, в воде некоторых озер и в подземных рассолах. В нашей стране содержание брома в подземных буровых водах, имеющих промышленное значение, составляет от 170 до 700 мг/л.
Соединения иода также имеются в морской воде, но в столь малых количествах, что непосредственное выделение их из воды очень затруднительно. Однако существуют некоторые водоросли, которые накапливают иод в своих тканях. Зола этих водорослей служит сырьем для получения иода. Значительные количества иода (от 10 до 50 мг/л) содержатся в подземных буровых водах. Иод встречается также в виде солей калия — иодата КЮз и перио-дата КЮ4, сопутствующих залежам нитрата натрия (селитры) в Чили и Боливии.
Иод при комнатной температуре представляет собой темно-фиолетовые кристаллы со слабым блеском. При нагревании под атмосферным давлением он сублимируется (возгоняется), превращаясь в пары фиолетового цвета;, при охлаждении пары иода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки иода от нелетучих примесей.
Самый тяжелый галоген — астат — в природе практически не встречается. Его получают путем искусственно осуществляемых ядерных реакций. Наиболее
118. Галогены в природе. Физические свойства галогенов
долгоживущий изотоп астата 2l0At имеет период полураспада всего 8,3 ч. Ничтожные количества астата обнаружены в продуктах естественного радиоактивного распада ураиа н тория.
Все галогены обладают очень резким запахом. Вдыхание их даже в небольших количествах вызывает сильное раздражение дыхательных путей и воспаление слизистых оболочек. Более значительные количества галогенов могут вызвать тяжелое отравление,-
Молекулы простых веществ, образуемых атомами галогенов, двухатомны. С увеличением в ряду F, CI, Br, I, At радиуса атомов возрастает поляризуемость молекул. В результате усиливается межмолекулярное дисперсионное взаимодействие, что обусловливает возрастание температур плавления и кипения галогенов.
В ряду С12—Вг2—12 прочность связи между атомами в молекуле постепенно уменьшается, что находит отражение в уменьшении энтальпии диссоциации молекул Э2 на атомы (табл. 23), Причины этого заключаются в следующем. С увеличением размеров внешних электронных облаков взаимодействующих атомов степень их перекрывания уменьшается, а область перекрывания располагается все дальше от атомных ядер. Поэтому при переходе от хлора к брому и иоду притяжение ядер атомов галогена к области перекрывания электронных облаков уменьшается. Кроме того, в ряду CI—Br—I возрастает число промежуточных электронных слоев, экранирующих ядро, что также ослабляет взаимодействие атомных ядер с областью перекрывания.
| Галогены сравнительно мало растворимы в воде. Один объем воды растворяет при комнатной температуре около 2,5 объемов |
 |
Уменьшение прочности связи в молекулах галогенов проявляется в падении их устойчивости к нагреванию: данные табл. 23 показывают, что при одной и той же температуре степень термической диссоциации молекул возрастает при переходе от С12 к Вг2 и 12. Однако из этих же данных следует, что фтор выпадает из общей закономерности: прочность связи между атомами в его молекуле меньше, а степень термической диссоциации молекул выше, чем у хлора. Такие аномальные свойства фтора можно объяснить отсутствием d-подуровня во внешнем электронном слое его атома. В молекуле хлора и других галогенов есть свободные d-орбитали, и поэтому между атомами имеет место дополнительное донорно-акцепторное взаимодействие, упрочняющее связь. Это показано на следующей схеме:
хлора. Раствор этот называется хлорной'водой. При пропускании хлора в охлажденную до 0°С воду из раствора выделяются зеленовато-желтые кристаллы клатратного соединения С12-8Н20. Растворимость брома при 20 °С составляет около 3,5 г, а растворимость иода всего 0,02 г на 100 г воды.
Фтор не может быть растворен в воде, так как энергично разлагает ее:
2F2 + 2Н20 = 4HF + 02f
Значительно лучше, чем в воде, бром и иод растворяются в органических растворителях*: сероуглероде, этиловом спирте, ди-этиловом эфире, хлороформе, бензоле. Этим пользуются для извлечения брома и иода из водных растворов. Если, например, взболтать водный раствор иода с небольшим количеством сероуглерода (не смешивающегося с водой), то почти весь иод перейдет из воды в сероуглерод, окрашивая его в фиолетовый цвет.
119. Химические свойства галогенов. Свободные галогены проявляют чрезвычайно высокую химическую активность. Они вступают во взаимодействие почти со всеми простыми веществами. Особенно быстро и с выделением большого количества теплоты протекают реакции соединения галогенов с металлами. Так, расплавленный металлический натрий в атмосфере хлора сгорает с ослепительной вспышкой, а на стенках сосуда появляется белый налет хлорида натрия:
2Na + С12 = 2NaCl
Медь, железо, олово и многие другие металлы сгорают в хлоре, образуя соответствующие соли. Подобным же образом взаимодействуют с металлами бром и иод. Во всех этих случаях атомы металла отдают электроны, т. е. окисляются, а атомы галогенов присоединяют электроны, т. е. восстанавливаются. Эта способность присоединять электроны, резко выраженная у атомов галогенов, является их характерным химическим свойством. Следовательно, галогены — очень энергичные окислители.
Окислительные свойства галогенов проявляются также и при взаимодействии их со сложными веществами. Приведем несколько примеров.
1. При пропускании хлора через раствор хлорида железа (II)
последний окисляется в хлорид железа(III), вследствие чего рас-
твор из бледно-зеленого становится желтым:
2FeCl2+ Cl2 = 2FeCl3
| * Фтор и хлор со многими органическими растворителями интенсивно реал гируют. |
2. Если к желтоватому водному раствору иода добавить серо-
водородной воды (водный раствор H2S), то жидкость обесцвечи-
вается и становится мутной от выделившейся серы:
H2S + I2 = S| + 2HI
3. При действии водного раствора брома на раствор сульфита натрия ИагБОз происходит обесцвечивание раствора, так как бром окисляет сульфит до сульфата натрия, а сам восстанавливается, превращаясь в бесцветный бромоводород. Реакция протекает при участии молекул воды и выражается уравнением Na2S03 + Вг2 + Н20 = Na2S04 + 2НВг
или в ионно-молекулярной форме:
SO2" + Вг2 + Н20 = SO2" + 2Н+ + 2ВГ
Химическая активность фтора исключительно высока. По образному выражению академика А. Е. Ферсмана, его можно назвать «всесъедающим». Щелочные металлы, свинец, железо загораются в атмосфере фтора при комнатной температурее. На некоторые металлы (Cu, Ni) фтор на холоду не действует, так как на их поверхности образуется защитный слой фторида. Однако при нагревании фтор реагирует со всеми металлами, в том числе с золотом и платиной.
Со многими неметаллами (водород, иод, бром, сера, фосфор, мышьяк, сурьма, углерод, кремний, бор) фтор взаимодействует на холоду; реакции протекают со взрывом или с образованием пламени;
Н2 + F2 = 2HF +541,4 кДж Si + 2F2=SiF4 +1615 кДж S + 3F2 = SFe +1207 кДж
При нагревании с фтором соединяются хлор, криптон и ксенон, например:
Xe + F2 = XeF2 +176 кДж
Непосредственно фтор не реагирует только с кислородом, азотом и углеродом (в виде алмаза).
Очень энергично протекает взаимодействие фтора со сложными веществами. В его атмосфере горят такие устойчивые вещества, как стекло (в виде ваты) и водяной пар:
Si02 + 2F2 = SiF4 + 02 + 657 кДж 2Н20 + 2F2 = 4HF + 02 +598 кДж
Интересно отметить, что при этом в качестве одного из продуктов горения образуется кислород.
Свободный хлор тоже проявляет очень высокую химическую активность, хотя и меньшую, чем фтор. Он непосредственно взаимодействует со всеми простыми веществами, за исключением кислорода, азота и благородных газов. Такие неметаллы, как фосфор, мышьяк, сурьма и кремний, уже при низкой температуре
реагируют с хлором; при этом выделяется большое количество
теплоты. Энергично протекает взаимодействие хлора с активными
металлами — натрием, калием, магнием и др. '
При комнатной температуре без освещения хлор практически не взаимодействует с водородом, но при нагревании или на ярком солнечном свету реакция протекает по цепному механизму (см. § 62) со взрывом.
Химическая активность брома и иода меньше, чем хлора, но все же велика. Со многими металлами и неметаллами (например, с фосфором) они реагируют в обычных условиях. При этом бром по активности мало уступает хлору, а иод отличается от хлора значительно.
Взаимодействие брома с водородом происходит лишь при нагревании. Иод с водородом реагирует только при достаточно сильном нагревании и не полностью, так как начинает идти обратная реакция — разложение иодоводорода:
H2 + I2 =F=* 2HI —53,1 кДж
Сравнение химических свойств галогенов показывает, что их окислительная активность последовательно уменьшается от фтора к астату. Этот эффект проявляется в способности более легких галогенов в виде простых веществ окислять галогенид-ионы более тяжелых галогенов и в способности более тяжелых галогенов восстанавливать кислородные соединения более легких галогенов:
F2 + 2Cr —> 2F- + C12
С12 + 2Вг" —>■ 2СГ + Вг2
Вг2 + 2Г —>■ 2Вг" + 12
12 + 2СЮз —> 2Ю- + С12
Несмотря на меньшую энергию сродства к электрону у фтора, чем у хлора (см. табл. 23), фтор является все же самым сильным окислителем среди галогенов. Объясняется это следующим. Превращение газообразного хлора или фтора в отрицательно заряженные ионы можно рассматривать как состоящее из двух стадий — диссоциации молекул на отдельные атомы
>/2Э2 —> Э
и присоединения электрона к образовавшемуся свободному атому галогена]
Э + е~ —> Э~
Первая стадия процесса требует затраты энергии на разрыв связей между
атомами галогена в молекуле; мерой этих энергетических затрат может слу-
жить энтальпия диссоциации молекул галогена. У хлора, состоящего из более
прочных молекул, энтальпия диссоциации в расчете на 1 моль атомов галогена
(121,5 кДж/моль) значительно выше, чем у фтора (79,5 кДж/моль). •
Вторая стадия процесса сопровождается выделением энергии (сродство к электрону); здесь выигрыш энергии в случае хлора (348,7 кДж/моль) несколько выше, чем в случае фтора (332,7 кДж/моль),
1 Как нетрудно подсчитать, общин выигрыш энергии в рассматриваемом процессе для фтора (253,2 кДж/моль) выше, чем для хлора (227,2 кДж/моль), что и характеризует фтор как более сильный окислитель.
Если реакция протекает в водном растворе, то следует учесть и энергию гидратации галогенид-ионов; при одинаковом заряде нона она тем выше, чем меньше радиус иона. Следовательно, при гидратации фторпд-пона F~ выделяется больше энергии, чем при гидратации иона С1~, так что н в водных растворах фтор будет более сильным окислителем, чем хлор.
Аналогичные расчеты показывают, что при переходе от хлора к брому и иоду выигрыш энергии в окислительных процессах, протекающих в водных растворах с участием галогенов"; также уменьшается. Этим и объясняется способность каждого галогена вытеснять более тяжелые галогены, находящиеся в степени окисленности —1, из растворов их соединений,
120. Получение и применение галогенов. В природных соединениях галогены содержатся (за редким исключением) в виде отрицательно заряженных ионов, поэтому почти все способы получения свободных галогенов сводятся к окислению их ионов. Это осуществляется или при помощи окислителей, или действием электрического тока.
Фтор, вследствие своей высокой электроотрицательности, может быть выделен из соединений только путем электролиза. Впервые он был получен в 1886 г. путем разложения электрическим током смеси безводного жидкого фтороводорода с KF. Этот метод применяется в настоящее время для промышленного получения фтора. Расплав состава KF + 2HF (температура плавления 70°С) подвергают электролизу. Электролиз ведут в никелевом сосуде, который является катодом, а анодом служит уголь. Катодное и анодное пространства разделены диафрагмой для предотвращения взрыва при смешивании продуктов электролиза — водорода и фтора.
Хлор получают в настоящее время в больших количествах путем электролиза водных растворов хлоридов натрия или калия. Хлор выделяется у анода, а у катода образуется соответственно гидроксид натрия или калия (см. § 197).
В лабораториях хлор получают действием различных окислителей на соляную кислоту. Напомним, например, известный из школьного курса лабораторный способ получения хлора действием диоксида марганца на соляную кислоту:
Мп02 + 4НС1 = МпС12 + С12 + 2Н20
В ионно-молекулярной форме эта реакция выразится уравнением
Мп02 + 2СГ + 4Н+ = Мп2+ + С12 + 2Н20
из которого видно, что здесь происходит окисление ионов С\~~ в атомы хлора (образующие затем молекулы С12) и восстановление марганца, входящего в состав Мп02, до степени окисленности +2 (ионы Мп2+). При помощи этой реакции хлор был впервые получен К- В. Шееле (Швеция) в 1774 г.
Аналогично можно получить хлор из соляной кислоты, действуя на нее такими окислителями, как Pb02, KCIO3, KMnCv
Кислород в обычных условиях не взаимодействует с НС1 в сколько-нибудь заметной степени. Но если пропускать НС1 и 02 через трубку, нагретую до 400 °С н содержащую кусочки пемзы, на которых распределен в качестве катализатора хлорид меди(П) СиС12, то происходит окисление хлороводорода кислородом
4НС1 + 02 2С12-г-2Н20
причем выход хлора достигает 80 %. Этой реакцией раньше пользовались для промышленного получения хлора.
Бром и иод могут быть получены аналогично хлору окислением НВг и Ш различными окислителями. В промышленности их обыч» но получают из бромидов или иодидов, действуя на их растворы хлором. Таким образом, получение брома и иода тоже основано на окислении их ионов, причем в качестве окислителя применяется хлор.
В СССР бром добывают главным образом из подземных буровых вод, а также из «рапы» (насыщенного раствора) некоторых соляных озер. Главным источником получения иода в СССР служат подземные буровые воды.
Галогены, особенно хлор, широко применяются в химической промышленности.
Фтор используют для получения некоторых ценных фторопро-изводных углеводородов, обладающих уникальными свойствами, как, например, смазочных веществ, выдерживающих высокую температуру, пластической массы, стойкой к химическим реагентам (тефлон), жидкостей для холодильных машин (фреонов, или хла-донов).
Хлор служит для приготовления многочисленных неорганических и органических соединений. Его применяют в производстве соляной кислоты, хлорной извести, гипохлоритов и хлоратов и др. Большое количество хлора используется для отбелки тканей и целлюлозы, идущей на изготовление бумаги. Хлор применяют также для стерилизации питьевой воды и обеззараживания сточных вод. В цветной металлургии его используют для хлорирования руд, которое является одной из стадий получения некоторых металлов.
Особенно большое значение приобрели за последнее время различные хлорорганические продукты. Хлорсодержащие органические растворители — например, дихлорэтан, четыреххлористый углерод — широко применяются для экстракции жиров и обезжиривания металлов. Некоторые хлорорганические продукты служат эффективными средствами борьбы с вредителями сельскохозяйственных культур. На основе хлорорганических продуктов изготовляют различные пластические массы, синтетические волокна, каучуки, заменители кожи (павинол), С развитием техники об-
ласть применения хлорорганических продуктов расширяется; это ведет к непрерывному увеличению производства хлора.
Широкое использование хлора в различных отраслях народ» ного хозяйства, а также масштабы его производства и потребления позволяют отнести хлор, наряду с серной кислотой, аммиаком и содой, к числу важнейших продуктов, выпускаемых химической промышленностью.
Бром необходим для выработки различных лекарственных веществ, некоторых красителей, а также бромида серебра, потребляемого при производстве фотоматериалов.
Иод применяют в медицине в виде так называемой йодной тинктуры (10 % раствор иода в этиловом спирте), превосходного антисептического и кровоостанавливающего средства. Кроме того, иод входит в состав ряда фармацевтических препаратов.
121. Соединения галогенов с водородом. Из соединений галогенов наиболее важное практическое значение имеют галогеново-дороды и соли галогеноводородов.
Химическая связь в молекулах галогеноводородов — полярная ковалентная: общая электронная пара смещена к атому галогена как более электроотрицательному. Некоторые свойства галогеноводородов приведены в табл. 24.
Прочность химической связи в молекулах галогеноводородов закономерно падает в ряду HF—НС1—НВг—HI: это проявляется в изменении энтальпии диссоциации молекул на атомы (табл. 24), Связь здесь ослабляется по тем же причинам, которые были рассмотрены при сопоставлении прочности молекул свободных галогенов (см. § 118). Как показывает схема (рис. 107), при переходе, например, от HF к HI уменьшается степень перекрывания электронных облаков атомов водорода и галогена, а область перекрывания располагается на большем расстоянии от ядра атома галогена и сильнее экранируется возросшим числом промежуточных электронных слоев. Кроме того, в ряду F—CI—Br—I электроотрицательность атома галогена уменьшается. Поэтому в молекуле HF электронное облако атома водорода смещается в сторону атома галогена в наибольшей степени, а в молекулах НС1, НВг и HI—■ все меньше и меньше. Это также приводит к уменьшению перекрывания взаимодействующих электронных облаков и, тем самым, к ослаблению связи между атомами.
С уменьшением прочности связи в молекулах галогеноводородов падает и их устойчивость к нагреванию. Термическая диссоциация фтороводорода происходит лишь при очень высоких температурах (более 3500 °С), тогда как иодоводород уже при 300°С 3 значительной степени распадается на иод и водород:
+53,1 кДж
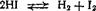
Все галогеноводороды — бесцветные газы с резким запахом.

Галогеноводороды очень хорошо растворимы в воде. При 0°С один объем воды растворяет около 500 объемов НС1, 600 объемов НВг и около 425 объемов HI (при 10°С); фтороводород смешивается с водой в любых соотношениях.
Растворение галогеноводородов сопровождается их диссоциацией по кислотному типу, причем только фтороводород диссоциирован сравнительно слабо, остальные же принадлежат к числу наиболее сильных кислот.

На воздухе концентрированные растворы галогеноводородов дымят вследствие выделения галогеноводородов, образующих Q водяными парами воздуха туман, который состоит из мелких капелек соответствующих кислот.
В ряду Ш—НВг—НС1 температуры кипения и плавления изменяются весьма закономерно (табл. 24), тогда как при переходе к HF они резко возрастают. Как уже говорилось в § 47, это обусловлено ассоциацией молекул фтороводорода в результате возникновения менаду ними водородных связей. Как показывает определение плотности пара, вблизи температуры кипения газообразный фтороводород состоит из агрегатов, имеющих средний состав (HF)4. При дальнейшем нагревании эти агрегаты постепенно распадаются, причем лишь около 90°С газообразный HF состоит из простых молекул.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 466; Нарушение авторских прав?; Мы поможем в написании вашей работы!