
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Характеристика вагонов 81-717(714) 16 страница
|
|
|
|
Некоторые свойства элементов главной подгруппы шестой группы приведены в табл. 25.
КИСЛОРОД (OXYGENIUM)
123. Кислород в природе. Воздух. Кислород — самый распространенный элемент земной коры. В свободном состоянии он находится в атмосферном воздухе, в связанном виде входит в состав воды, минералов, горных пород и всех веществ, из которых построены организмы растений и животных. Массовая доля кислорода в земной коре составляет около 47 %.
Природный кислород состоит из трех стабильных изотопов: )fiO (99,76 %), 170 (0,04 %) и 1?0 (0,2%).
Атмосферный воздух представляет собой смесь многих газов. Кроме кислорода и азота, образующих основную массу воздуха, в состав его входят в небольшом количестве благородные газы, диоксид углерода и водяные пары. Помимо перечисленных газов, в воздухе содержится еще большее или меньшее количество ныли и некоторые случайные примеси. Кислород, азот и благородные газы считаются постоянными составными частями возд>ха, так как их содержание в воздухе практически повсюду одинаково. Содержание же диоксида углерода, водяных паров и пыли может изменяться в зависимости от условий.
Диоксид углерода образуется в природе прн горении дерева и угля, дыхании животных, гниении. Особенно много С02 как продукта сжигания огромных количеств топлива поступает в атмосферу в больших промышленных центрах.
В некоторых местах земного шара С02 выделяется в воздух вследствие вулканической деятельности, а также из подземных источников. Несмотря на непрерывное поступление диоксида углерода в атмосферу, содержание его в воздухе довольно постоянно и составляет в среднем около 0,03 % (об.). Это объясняется поглощением диоксида углерода растениями, а также его растворением в воде.
Водяные пары могут находиться в воздухе в различных количествах. Содержание их колеблется от долей процента до нескольких процентов и зависит от местных условий и от температуры.
Пыль, находящаяся в воздухе, состоит главным образом из мельчайших частиц минеральных веществ, образующих земную кору, частичек угля, пыльцы растений, а также различных бактерий. Количество пыли в воздухе очень изменчиво: зимой ее меньше,
летом больше. После дождя воздух становится чище, так как капли дождя увлекают с собой пыль.
Наконец, к случайным примесям воздуха относятся такие вещества, как сероводород и аммиак, выделяющиеся при гниении органических остатков; диоксид серы S02, получающийся при обжиге сернистых руд или при горении угля, содержащего серу; оксиды азота, образующиеся при электрических разрядах в атмосфере, и т. п. Эти примеси обычно встречаются в ничтожных количествах и постоянно удаляются из воздуха, растворяясь в дождевой воде.
Если учитывать только постоянные составные части воздуха, то его состав можно выразить данными, приведенными в табл. 26.
Масса 1 л воздуха при 20 °С и нормальном атмосферном давлении равна 1,293 г. При температуре —140°С и давлении около 4 МПа воздух конденсируется в бесцветную прозрачную жидкость.
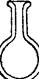
Несмотря на низкую при обычном давлении температуру кипения (около —190°С), жидкий воздух можно довольно долго сохранять в сосудах Дьюара — стеклянных сосудах с двойными стенками, из пространства между которыми воздух откачан (рис. 109).
В жидком воздухе легко переходят в твердое состояние этиловый спирт, диэтиловый эфир и многие газы. Если, например, пропускать через жидкий воздух диоксид углерода, то он превращается в белые хлопья, похожие по внешнему виду на снег. Ртуть, погруженная в жидкий воздух, становится твердой и ковкой.
| Т> |
|
Многие вещества, охлажденные жидким воздухом, резко изменяют свои свойства. Так, цинк и олово становятся настолько хрупкими, что легко превращаются в порошок, свинцовый колокольчик издает чистый звенящий звук, а замороженный резиновый мячик разбивается вдребезги, если уронить его на пол.
Поскольку температура кипения кислорода (—183 °С) лежит выше, чем температура кипения азота (—195,8 °С), то кислород легче превращается в жидкость, чем азот. Поэтому жид-
Рис. 109. Сосуды Дьюара (в разрезе),
кий воздух богаче кислородом, чем атмосферный. При хранении жидкий воздух еще больше обогащается кислородом вследствие преимущественного испарения азота.
Жидкий воздух производят в больших количествах. Он используется главным образом для получения из него кислорода, азота и благородных газов; разделение производят путем ректификации—дробной перегонки.
124. Получение и свойства кислорода. Кислород был впервые получен в чистом виде К. В. Шееле в 1772 г., а затем в 1774 г, Д. Пристли (Англия), который выделил его из оксида ртути(II), Однако Пристли не знал, что полученный им газ входит в состав воздуха. Только спустя несколько лет Лавуазье, подробно изучивший свойства этого газа, установил, что он является составной частью воздуха.
В настоящее время в промышленности кислород получают из воздуха (см. § 123). В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа. Важнейшим лабораторным способом его получения служит электролиз водных растворов щелочей. Небольшие количества кислорода можно также получать взаимодействием раствора перманганата калия с подкисленным раствором пероксида водорода (см. стр. 337) или термическим разложением некоторых кислородсодержащих веществ, например перманганата калия:
2KMn04 = К2Мп04 + Мп02 + 02f
Кислород—бесцветный газ, не имеющий запаха. Он немного тяжелее воздуха: масса 1 л кислорода при нормальных условиях равна 1,43 г, а 1 л воздуха 1,293 г. Кислород растворяется в воде, хотя и в небольших количествах: 100 объемов воды при 0°С растворяют 4,9, а при 20°С — 3,1 объема кислорода.
Кислород образует двухатомные молекулы, характеризующиеся высокой прочностью: стандартная энтальпия атомизации кислорода равна 498 кДж/моль. При комнатной температуре его диссоциация на атомы ничтожна; лишь при 1500 °С она становится заметной.
Как уже упоминалось (см. стр. 136), магнитные свойства кислорода указывают на наличие в молекуле 02 двух неспаренных электронов. Эти электроны размещаются на разрыхляющих молекулярных л-орбиталях (рис. 52 на стр. 142). Парамагнитность кислорода проявляется, в частности, в том, что жидкий кислород притягивается магнитом.
Кислород образует соединения со всеми химическими элементами, кроме гелия, неона и аргона. С большинством элементов ой взаимодействует непосредственно (кроме галогенов, золота и платины). Скорость взаимодействия кислорода как с простыми, так и со сложными веществами зависит of природы вещества и рт температуры. Некоторые вещества, например оксид азота (II), гемоглобин крови, уже при комнатной температуре соединяются с кислородом воздуха со значительной скоростью. Многие реакции окисления ускоряются катализаторами. Например, в присутствии дисперсной платины смесь водорода с кислородом воспламеняется при комнатной температуре. Характерной особенностью многих реакций соединения с кислородом является выделение теплоты и света. Такой процесс называется горением.
Горение в чистом кислороде происходит гораздо энергичнее, чем в воздухе. Хотя при этом выделяется такое же количество теплоты, как и при горении в воздухе, но процесс протекает быстрее и выделяющаяся теплота не тратится на нагревание азота воздуха; поэтому температура горения в кислороде значительно выше, чем в воздухе.
Кислород играет исключительно важную роль в природе. При участии кислорода совершается один из важнейших жизненных процессов — дыхание. Важное значение имеет и другой процесс, в котором участвует кислород, — тление и гниение погибших животных и растений; прн этом сложные органические вещества превращаются в более простые (в конечном результате в СОг, воду и азот), а последние вновь вступают в общий круговорот веществ в природе.
Применение кислорода весьма многообразно. Его применяют для интенсификации химических процессов во многих производствах (например, в производстве серной и азотной кислот, в доменном процессе). Кислородом пользуются для получения высоких температур, для чего различные горючие газы (водород, ацетилен) сжигают в специальных горелках. Кислород используют в медицине при затрудненном дыхании.
Смеси жидкого кислорода с угольным порошком, древесной мукой или другими горючими веществами называются оксиликвитами. Они обладают очень сильными взрывчатыми свойствами и применяются при подрывных работах.
125. Озон. При пропускании электрических искр через кислород или воздух появляется характерный запах, причиной которого является образование нового вещества — озона. Озон можно получить из совершенно чистого сухого кислорода; отсюда следует, что он состоит только из кислорода и представляет собой его аллотропическое видоизменение.
Молекулярная масса озона равна 48. Атомная же масса кислорода равна 16*; следовательно, молекула озона состоит из трех атомов кислорода.
| * Точнее, соответственно 47,9982 и 15,9994, |
Для получения озона пользуются действием тихих электрических разрядов иа кислород. Приборы, служащие для этой цели, называются озонаторами.
При обычных условиях озон — газ. От кислорода его можно отделить сильным охлаждением; озон конденсируется в синюю жидкость, кипящую при —111,9 °С.
Растворимость озона в воде значительно больше, чем кислорода: 100 объемов воды при 0°С растворяют 49 объемов озона.
Образование озона из кислорода можно выразить уравнением 30г = 203 —285 кДж
из которого следует, что стандартная энтальпия образования озона положительна и равна 142,5 кДж/моль. Кроме того, как показывают коэффициенты уравнения, в ходе этой реакции из трех молекул газа получаются две молекулы, т. е. энтропия системы уменьшается. В итоге, стандартное изменение энергии Гиббса в рассматриваемой реакции также положительно (163 кДж/моль). Таким образом, реакция превращения кислорода в озон самопроизвольно протекать не может: для ее осуществления необходима затрата энергии. Обратная же реакция — распад озона — протекает самопроизвольно, так как в ходе этого процесса энергия Гиббса системы уменьшается. Иначе говоря, озон — неустойчивое вещество.
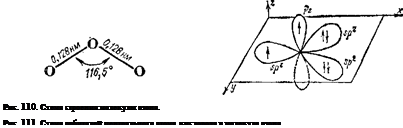
Молекула озона построена в форме равнобедренного треугольника. Ее структура схематически изображена на рис. 110. Близость угла при вершине треугольника к 120° указывает на то, что центральный атом кислорода находится здесь в состоянии sp2-rn6-ридизации. В соответствии с этим, с позиций метода ВС образование молекулы 03 можно описать следующим образом.
Гибридная 5,о2-орбиталь центрального атома, содержащая один электрон (рис. 111, слева), перекрывается с рх-орбиталью одного из крайних атомов кислорода, в результате чего образуется а-связь. Не участвующая в гибридизации /ь-орбиталь центрального атома, ориентированная перпендикулярно к плоскости молекулы и также содержащая неспаренный электрон, перекрывается с аналогично расположенной рг-орбиталью того же крайнего атома кислорода, что приводит к образованию л-связи. Наконец, выступая в качестве донора электронной пары, занимающей одну из гибридных «р2-орбиталей (рис. 111, справа), центральный атом кислорода образует по донорно-акцепторному способу а-связь с другим крайним атомом кислорода. Образовавшейся структуре соответствует валентная схема А, на которой точками обозначены неподеленные пары электронов, а а- и л-связи помечены буквами.
:о jot го: о:
Согласно схеме А, связи центрального атома кислорода с двумя крайними атомами неравноценны — одна из них двойная, а другая простая. Однако одинаковая длина этих связей (рис. ПО) указывает на их равноценность. Поэтому, наряду со схемой А, строение Молекулы озона с равным основанием можно описать схемой Б, С позиций метода наложения валентных схем (см. § 44) это означает, что в действительности структура молекулы озона является промежуточной между схемами А и Б н ее можно представить в форме:
4%
О
о' Ъ
Здесь пунктирные линии указывают на делокализацию л-элек-тронной пары, т. е. на принадлежность ее всем трем атомам кислорода. Следовательно, л-связь в молекуле озона — трехцентровая.
Рассмотрение строения молекулы озона с позиций метода МО также приводит к выводу об образовании здесь трехцентровой связывающей молекулярной л-орбитали.
Озон —один из сильнейших окислителей. Он окисляет все металлы, кроме золота и платиновых металлов, а также большинство неметаллов. Он переводит низшие оксиды в высшие, а сульфиды металлов — в их сульфаты. В ходе большинства этих реакций молекула озона теряет один атом кислорода, переходя в молекулу 02.
Из раствора иодида калия озон выделяет иод: 2KI + Н20 + 03 = I2 + 2КОН + 02
Если поместить в воздух, содержащий озон, бумажку, смоченную растворами KI и крахмала, то она тотчас же синеет. Этой реакцией пользуются для открытия озона.
Как сильный окислитель озон убивает бактерии и потому применяется для обеззараживания воды и для дезинфекции воздуха.
Озон ядовит. Предельно допустимым является его содержание в воздухе, равное 10_5%. При этой концентрации хорошо ощущается его запах. В приземном слое атмосферы содержание озона обычно лежит в пределах 10~7—10_5%; он образуется в атмосфе«ре при электрических разрядах.
127. Свойства и применение серы
СЕРА, СЕЛЕН, ТЕЛЛУР
126. Сера в природе. Получение серы. Сера (Sulfur) встречает-
ся в природе как в свободном состоянии (самородная сера), так
и в различных соединениях. В Советском Союзе залежи самород-
ной серы находятся в Туркмении в пустыне Кара-Кум, в Узбекской
ССР, по берегам Волги. За рубежом наиболее крупные месторо-
ждения серы находятся в США, Италии и Японии.
Очень распространены соединения серы с различными металлами. Многие из них являются ценными рудами (например, свинцовый блеск PbS, цинковая обманка ZnS, медный блеск Cu2S) п служат источником получения цветных металлов.
Из соединений серы в природе распространены также сульфаты, главным образом, кальция и магния. Наконец, соединения серы содержатся в организмах растений и животных.
Общее содержание серы в земной коре составляет приблизительно 0,1 %.
Самородная сера содержит посторонние вещества, для отделения которых пользуются способностью серы легко плавиться. Однако сера, полученная выплавкой из руды (комовая сера), обычно содержит еще много примесей. Дальнейшую ее очистку производят перегонкой в рафинировочных печах, где сера нагревается до кипения. Пары серы поступают в выложенную кирпичом камеру. Вначале, пока камера холодная, сера прямо переходит в твердое состояние и осаждается иа стенках в виде светло-желтого порошка (серный цвет). Когда камера нагреется выше 120 °С, пары конденсируются в жидкость, которую выпускают из камеры в формы, где она и застывает в виде палочек. Полученная таким образом сера называется черенковой.
Важным источником получения серы служит оюелезный колчедан FeS2, называемый также пиритом, и полиметаллические руды, содержащие сернистые соединения меди, цинка и других цветных металлов. Некоторое количество серы (газовая сера) получают из газов, образующихся при коксовании и газификации угля.
127. Свойства и применение серы. При обычных давлениях сера
образует хрупкие кристаллы желтого цвета, плавящиеся при
112,8°С; плотность ее 2,07 г/см3. Она нерастворима в воде, но до-
вольно хорошо растворяется в сероуглероде, бензоле и некоторых
других жидкостях. При испарении этих жидкостей сера выделяется
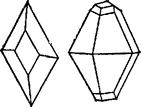
из раствора в виде прозрачных желтых кристаллов ромбической
системы, имеющих форму октаэдров, у которых обычно часть уг-
лов или ребер как бы срезана (рис. 112). Эта модификация серы
называется ромбической.
Иной формы кристаллы получаются, если медленно охлаждать расплавленную серу и, когда она частично затвердевает, слить еще не успевшую застыть жидкость. При этих условиях стенки сосуда оказываются покрытыми изнутри длинными темно-желтыми игольчатыми кристаллами моноклинной системы (рис. 113). Эта модификация серы называется моноклинной. Она имеет плотность 1,96 г/см3, плавится при 119,3°С и устойчива только при температуре выше 96°С. При более низкой температуре кристал-
|
-, Рис. 112. Кристаллы ромбической серы (1 и [[). Рис. ИЗ. Кристалл моноклинной серы (Ш).
лы моноклинной серы светлеют, превращаясь в октаэдры ромбической серы.
vjg^ Определение молекулярной мас-щ сы серы по понижению температуры замерзания ее растворов в бензоле приводит к заключению, что молекулы серы состоят из восьми атомов (Ss). Из таких же молекул Se, имеющих кольцевое строение, построены кристаллы ромбической и моноклинной серы. Таким образом, различие в свойствах кристаллических модификаций серы обусловлено не различным числом атомов в молекулах (как, например, в молекулах кислорода и озона), а неодинаковой структурой кристаллов.
Интересны изменения, которые претерпевает сера, если медленно нагревать ее до кипения. При 112,8°С она плавится, превращаясь в желтую легкоподвижную жидкость. При дальнейшем нагревании жидкость темнеет, приобретая красновато-бурый цвет, и при температуре около 250°С становится настолько вязкой, что не выливается из опрокинутого сосуда. Выше 300°С жидкая сера снова становится подвижной, но цвет ее остается таким же темным. Наконец, при 444,6 °С сера закипает, образуя оранжево-желтые пары. При охлаждении те же явления повторяются в обратном порядке.
Описанные изменения имеют следующее объяснение. При температурах, превышающих 150—160 °С, кольцевые молекулы серы Ss начинают разрываться. Образующиеся цепочки атомов соединяются друг с другом — получаются длинные цепи, вследствие чего вязкость расплава сильно увеличивается. Дальнейшее нагревание приводит к разрыву этих цепей, и вязкость серы вновь снижается.
Если расплавленную серу, нагретую до кипения, вылить тонкой струей В холодную воду, то она превращается в мягкую резиноподобную коричневую массу, растягивающуюся в нити. Эта модификация серы называется пластической серой. Пластическая сера уже через несколько часов становится хрупкой, приобретает желтый цвет и постепенно превращается в ромбическую.
В парах серы с увеличением температуры число атомов в молекуле постепенно уменьшается: S8->- Se-*- S4 S2->- S. При 800— 1400°C пары серы состоят главным образом из молекул S2, при 1700°С — из атомов.
Сера — типичный неметалл. Со многими металлами, например г медью, железом, цинком, сера соединяется непосредственно с выделением большого количества теплоты. Она соединяется также 1:очти со всеми неметаллами, но далеко не так легко и энергично, как с металлами,
Сера широко используется в народном хозяйстве. В резиновой промышленности ее применяют для превращения каучука в резину; своп ценные свойства каучук приобретает только после смешивания с серой и нагревания до определенной температуры. Такой процесс называется вулканизацией каучука (стр. 488). Каучук с очень большим содержанием серы называют эбонитом; это хороший электрический изолятор.
В виде серного цвета серу используют для уничтожения некоторых вредителей растений. Она применяется также для приготовления спичек, ультрамарина (синяя краска), сероуглерода и ряда других веществ. В странах, богатых серой, она служит сырьем для получения серной кислоты.
128. Сероводород. Сульфиды. При высокой температуре сера взаимодействует с водородом, образуя газ сероводород.
Практически сероводород обычно получают действием разбавленных кислот на сернистые металлы, например на сульфид железа:
FeS + 2нс1 = FeCl2 + h2Sf
Сероводород—бесцветный газ с характерным запахом гниющего белка. Он немного тяжелее воздуха, сжижается при —60,3 °С и затвердевает при —85,6°С. На воздухе сероводород горит голубоватым пламенем, образуя диоксид серы и воду:
2h2s + 302 = 2н20 + 2s03
Если внести в пламя сероводорода какой-нибудь холодный предмет, например фарфоровую чашку, то температура пламени значительно понижается и сероводород окисляется только до свободной серы, оседающей на чашке в виде желтого налета:
2h2s + 02 = 2нго + 2s
Сероводород легко воспламеняется; смесь его с воздухом взрывает. Сероводород очень ядовит. Длительное вдыхание воздуха, содержащего этот газ даже в небольших количествах, вызывает тяжелые отравления.
При 20 °С один объем воды растворяет 2,5 объема сероводорода. Раствор сероводорода в воде называется сероводородной водой. При стоянии на воздухе, особенно на свету, сероводородная вода скоро становится мутной от выделяющейся серы. Это происходит в результате окисления сероводорода кислородом воздуха (см. предыдущую реакцию). Раствор сероводорода в воде обладает свойствами кислоты.
Сероводород — слабая двухосновная кислота. Она диссоциирует ступенчато и в основном по первой ступени:
h2s ч=* h+ + hs- (л:, = в • ю-8)
Диссоциация по второй ступени
HS" H+ + S2" (yc2=10~14)
протекает в ничтожно малой степени.
Сероводород — сильный восстановитель. При действии сильных окислителей он окисляется до диоксида серы или до серной кислоты; глубина окисления зависит от условий: температуры, рН раствора, концентрации окислителя. Например, реакция с хлором обычно протекает до образования серной кислоты:
H2S + 4С12 + 4Н20 = H2S04 + 8НС1
Сероводород встречается в природе в вулканических газах и в водах минеральных источников. Кроме того, он образуется при разложении белков погибших животных и растений, а также при гниении пищевых отбросов.
Средние соли сероводорода называются сульфидами. Их можно получать различными способами, в том числе непосредственным соединением металлов с серой. Смешав, например, железные опилки с порошком серы и нагрев смесь в одном месте, можно легко вызвать реакцию железа с серой, которая дальше идет сама и сопровождается выделением большого количества теплоты:
Fe + S = FeS +100,4 кДж
Многие сульфиды молено получить, действуя сероводородом на растворимые в воде соли соответствующих металлов. Например, при пропускании сероводорода через раствор какой-нибудь соли меди(II) появляется черный осадок сульфида меди (II)
CuS04 + H2S = CuS| + H2S04
или в ионно-молекулярной форме:
Cu2+ + H2S = CuS; + 2H+
Несмотря на то, что в ходе реакции получается кислота, CuS выпадает в осадок: сульфид меди не растворяется ни в воде, ни в разбавленных кислотах. Но при действии сероводорода на раствор какой-либо соли железа (II) осадка не получается — сульфид железа (II) FeS нерастворим в воде, но растворяется в кислотах. Это различие обусловлено тем, что произведение растворимости CuS много меньше произведения растворимости FeS (см. табл. 16 на стр. 242). О взаимодействии сульфидов металлов с кислотами более подробно говорится в § 91.
. Некоторые сульфиды растворимы в воде, например, Na2S и K2S. Понятно, что они не могут быть получены из солей соответствующих металлов действием сероводорода или других сульфидов.
Различиями в растворимости сульфидов пользуются в аналитической химии для последовательного осаждения металлов из растворов их солей.
Сульфиды, как соли очень слабой кислоты, подвергаются гидролизу. Например, Na2S при растворении в воде почти целиком гидролизуется с образованием кислой соли — гидросульфида натрия:
Na2S+H20:?=*: NaHS+NaOH
ИЛИ
S2' + H20 HS- + OH"
Серебряные и медные предметы чернеют в воздухе и в воде, содержащих сероводород. Это происходит оттого, что они покрываются налетом соответствующего сульфида. При этом окислителем служит кислород, находящийся в воздухе или растворенный в воде:
4Ag + 2H2S + 02 = 2Ag2S + 2Н20
При взбалтывании раствора какого-нибудь сульфида, например сульфида натрия, с серой последняя растворяется в нем, и после выпаривания получается остаток, содержащий, кроме сульфида натрия, также соединения с большим содержанием серы —от Na2S2 до Na2S5. Такие соединения называются полисульфидами или многосернистыми металлами.
Среди сульфидов имеется много соединений переменного состава. Например, сульфид железа(II) может иметь состав от FeSi.ni до FeSi.u.
Природные сульфиды составляют основу руд цветных и редких металлов и широко используются в металлургии. Некоторые из них служат также сырьем для получения серной кислоты. В этих же целях используется и природный полисульфид — железный колчедан (пирит) FeS2 (см. §§ 126 и 129). Сульфиды щелочных и щелочноземельных металлов находят применение в химической и в легкой промышленности. Так, Na2S, CaS и BaS применяются в кожевенном производстве для удаления волосяного покрова с кож. Сульфиды щелочноземельных металлов, цинка и кадмия служат основой люминофоров (см. стр. 604). Некоторые сульфиды обладают полупроводниковыми свойствами и применяются в электронной технике.
129. Диоксид серы. Сернистая кислота. Диоксид (двуокись) серы S02 образуется при сжигании серы в воздухе или кислороде. Он получается также при прокаливании на воздухе («обжигании») сульфидов металлов, например железного колчедана:
4FeS2 + 1102 = 2Fe203 + 8S03
По этой реакции диоксид серы получают обычно в промышленности (о других промышленных способах получения Зб2 см, 9 § 131),
Диоксид серы — бесцветный газ («сернистый газ») с резким запахом горячей серы. Он довольно легко конденсируется в бесцветную жидкость, кипящую при —10,0 °С. При испарении жидкого S02 происходит сильное понижение температуры (до —50 °С).
Диоксид серы хорошо растворяется в воде (около 40 объемов в 1 объеме воды при 20 °С); при этом частично происходит реакция с водой и образуется сернистая кислота:
S02 + h20 h2S03
Таким образом, диоксид серы является ангидридом сернистой кислоты. При нагревании растворимость S02 уменьшается и равновесие смещается влево; постепенно весь диоксид серы снова выделяется из раствора.
Молекула S02 построена аналогично молекуле озона. Ядра составляющих ее атомов образуют равнобедренный треугольник:
Здесь атом серы, как и центральный атом кислорода в моЛе-куле озона, находится в состоянии А'/?2-гибридизации и угол OSO близок к 120°. Ориентированная перпендикулярно к плоскости молекулы рг-орбиталь атома серы не участвует в гибридизации. За счет этой орбитали и аналогично ориентированных рг-орбита-лей атомов кислорода образуется трехцентровая л-связь; осуществляющая ее пара электронов принадлежит всем трем атомам молекулы.
Диоксид серы применяют для получения серной кислоты, а также (в значительно меньших количествах) для беления соломы, шерсти, шелка и как дезинфицирующее средство (для уничтожения плесневых грибков в подвалах, погребах, винных бочках, бродильных чанах).
Сернистая кислота H2S03 — очень непрочное соединение. Она известна только в водных растворах. При попытках выделить сернистую кислоту она распадается на SO2 и воду. Например, при действии концентрированной серной кислоты на сульфит натрия вместо сернистой кислоты выделяется диоксид серы:
NaS03 + H2S04 = Na2S04 + S02f + H20
Раствор сернистой кислоты необходимо предохранять от доступа воздуха, иначе она, поглощая из воздуха кислород, медленно окисляется в серную кислоту:
2H2S03 + 02 = 2H2S04
Сернистая кислота — хороший восстановитель. Например, свободные галогены восстанавливаются ею в галогеноводороды:
H2S03 + С12 + НаО = H2S04 + 2НС1
№ь* V Ко * M^ + ibyj
Однако при взаимодействии с сильными восстановителями сернистая кислота может играть роль окислителя. Так, реакция ее с сероводородом в основном протекает согласно уравнению:
H2S03 + 2H2S
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 413; Нарушение авторских прав?; Мы поможем в написании вашей работы!