
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Характеристика вагонов 81-717(714) 19 страница
|
|
|
|
В лаборатории оксид азота (II) обычно получают взаимодействием 30—35 %-ной азотной кислоты с медью:
3Cu + 8HN03 = 3Cu(N03)2 + 2NOf + 4Н20
В промышленности он является промежуточным продуктом при производстве азотной кислоты (см. § 143).
Для оксида азота (II) характерна окислительно-восстановительная двойственность. Под действием сильных окислителей он окисляется, а в присутствии сильных восстановителей — восстанавливается. Например, ои легко окисляется кислородом воздуха до диоксида азота:
2NO + 02 = 2Ш2
В то же время смесь равных объемов NO и Н2 при нагревании взрывает:
2NO + 2F2 = N2 + 2Н20 +655 кДж
Электронная структура молекулы NO лучше всего описывается методом МО. На рис. 116 представлена схема заполнения МО в молекуле NO (ср. с аналогичными схемами для молекул N2 и СО — рис. 51 и 53 на стр. 142 и 143). Молекула NO имеет на один электрон больше, чем молекулы N2 и СО: этот электрон находится на разрыхляющей орбитали яразр2р. Таким образом, число связывающих электронов превышает здесь число разрыхляющих на пять. Это соответствует кратности связи 2,5 (5:2 = 2,5). Действительно, энергия диссоциации молекулы NO на атомы (632 кДж/моль) имеет промежуточное значение по сравнению с соответствующими величинами для молекулы 02 (498 кДж/моль), в которой кратность связи равна двум, и молекулы N2
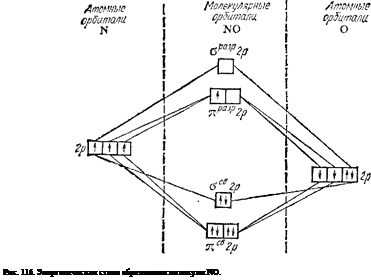
(945 кДж/моль), где связь тройная. Вместе с тем, по энергии диссоциации молекула N0 близка к молекулярному иону кислорода 0^ (644 кДж/моль), в котором кратность связи также равна 2,5 (см. стр. 142).
При отрыве от молекулы N0 одного электрона образуется ион N0+, не содержащий разрыхляющих электронов; кратность связи между атомами возрастает при этом до трех (шесть связывающих электронов). Поэтому энергия диссоциации иона N0+ (1050 кДж/моль) выше энергии диссоциации молекулы N0 и близка к соответствующей величине для молекулы СО (1076 кДж/моль), в которой кратность связи равна трем. v Диоксид (или двуокись) азота N02 — бурый ядовитый газ, обладающий характерным запахом. Он легко сгущается в красноватую жидкость (темп. кип. 21 °С), которая при охлаждении постепенно светлеет и при —11,2°С замерзает, образуя бесцветную кристаллическую массу. При нагревании газообразного диоксида азота его окраска, наоборот, усиливается, а при 140°С становится почти черной. Изменение окраски диоксида азота при повышении температуры сопровождается и изменением его молекулярной массы. При низкой температуре плотность пара приблизительно отвечает удвоенной формуле N204. С повышением температуры плотность пара уменьшается и при 140°С соответствует формуле N02. Бесцветные кристаллы, существующие при — 11,2°С и ниже, состоят из молекул N204. По мере нагревания молекулы N204 диссоциируют с образованием молекул темно-бурого диоксида азота; полная диссоциация происходит при 140°С. Таким образом, при температурах от —11,2 до 140°С молекулы N02 и N204 находятся в равновесии друг с другом:
N204 2N02 -56,9 кДж
Выше 140 °С начинается диссоциация N02 на N0 и кислород. Диоксид азота — очень энергичный окислитель. Многие вещества могут гореть в атмосфере N02, отнимая от него кислород. Диоксид серы окисляется им в триоксид, на чем основан нитроз-ный метод получения серной кислоты (см. § 131).
Пары JV02 ядовиты. Вдыхание их вызывает сильное раздражение дыхательных путей и может привести к серьезному отравлению.
При растворении в воде N02 вступает в реакцию с водой, образуя азотную и азотистую кислоты:
2N02 + Н20 = HN03 + HN02
Поэтому диоксид азота можно считать смешанным ангидридом этих кислот.
Но азотистая кислота очень нестойка и быстро разлагается: ЗШ02 = ШОз + 2N0 + Н20
Поэтому практически взаимодействие диоксида азота с водой| особенно с горячей, идет согласно уравнению
6N02 + 2Н20 = 4HN03 + 2N0
которое можно получить сложением двух предыдущих уравнений, если предварительно первое из них умножить на три.
В присутствии воздуха образующийся оксид азота немедленно окисляется в диоксид азота, так что в этом случае N02 в конечном итоге полностью переходит в азотную кислоту: 4N02 + 02 + 2Н20 = 4НШ3
Эта реакция используется в современных способах получения азотной кислоты.
Если растворять диоксид азота в щелочах, то образуется смесь солей азотной и азотистой кислот, например:
2N02 + 2NaOH = NaN03 + NaN02 + H20
Оксид азота(Ш), или азотистый ангидрид, N203 представляет собой темно-синюю жидкость, уже при низких температурах разлагающуюся на N0 и N02. Смесь равных объемов N0 и N02 при охлаждении вновь образует N203:
N0 + N02 ч=*: N203
Оксиду азота (III) соответствует азотистая кислота HN02. Оксид азота (V), или азотный ангидрид, Ы20б — белые кристаллы, уже при комнатной температуре постепенно разлагающиеся
на N02 и 02. Он может быть получен действием фосфорного ангидрида на азотную кислоту:
2HN03 + Р205 = N2Os + 2HPOe
Оксид азота (V) —очень сильный окислитель. Многие органические вещества при соприкосновении с ним воспламеняются. В воде оксид азота(V) хорошо растворяется с образованием азотной кислоты.
В твердом состоянии N205 образован нитратным ионом NOJ и ионом нптрония NOJ. Последний содержит такое же число электронов, что и
молекула С02 и, подобно последней, имеет линейное строение: 0 = N = 0. В парах молекула Ns05 симметрична; ее строение может быть представлено следующей валентной схемой, в которой пунктиром показаны трехцентровые связи (ср. с валентной схемой молекулы азотной кислоты на стр. 134):
-к—о—n;
141. Азотистая кислота. Если нагревать нитрат калия или натрия, то они теряют часть кислорода и переходят в соли азотистой кислоты HN02. Разложение идет легче в присутствии свинца, связывающего выделяющийся кислород:
KN03 + РЬ = KN02 + РЬО
Соли азотистой кислоты — нитриты — образуют кристаллы, хорошо растворимые в воде (за исключением нитрита серебра). Нитрит натрия NaN02 применяется при производстве различных красителей.
При действии на раствор какого-нибудь нитрита разбавленной серной кислотой получается свободная азотистая кислота:
2NaN02 + H2S04 = Na2S04 + 2HN02
Она принадлежит к числу слабых кислот (К — 4 • 10~4) и известна только в сильно разбавленных водных растворах. При концентрировании раствора или при его нагревании азотистая кислота распадается:
2HN02 = NO + N02 + Н20
Степень окисленности азота в азотистой кислоте равна +3, т. е. является промежуточной между низшими и высшей из возможных значений степени окисленности азота. Поэтому HN02 проявляет окислительно-восстановительную двойственность. Под действием восстановителей она восстанавливается (обычно до N0), а в реакциях с окислителями — окисляется до HNO3. Примерами могут служить следующие реакции:
2HN02 + 2KI + H2S04 = 2NOf + I2 + K2S04 + 2H20 5HN02 + 2KMn04 + 3H2S04 = 5HN03 + 2MnS04 + K2S04 + 3H20
142. Азотная кислота. Чистая азотная кислота HN03 — бесцветная жидкость плотностью 1,51 г/см3, при —42 °С застывающая в прозрачную кристаллическую массу. На воздухе она, подобно концентрированной соляной кислоте, «дымит», так как пары ее образуют с влагой воздуха мелкие капельки тумана.
Азотная кислота не отличается прочностью. Уже под влиянием света она постепенно разлагается:
4HN03 = 4N02f + 02f + 2Н20
Чем выше температура и чем концентрированнее кислота, тем быстрее идет разложение. Выделяющийся диоксид азота растворяется в кислоте и придает ей бурую окраску.
Азотная кислота принадлежит к числу наиболее сильных кислот; в разбавленных растворах она полностью распадается на
ионы Н+ и Шз"-
Характерным свойством азотной кислоты является ее ярко выраженная окислительная способность. Азотная кислота —один из энергичнейших окислителей. Многие неметаллы легко окисляются ею, превращаясь в соответствующие кислоты. Так, сера при кипя» чении с азотной кислотой постепенно окисляется в серную кислоту, фосфор — в фосфорную. Тлеющий уголек, погруженный в концен* трированную HN03, ярко разгорается.
Азотная кислота действует почти на все металлы (за исключением золота, платины, тантала, родия, иридия), превращая их в нитраты, а некоторые металлы — в оксиды.
Концентрированная HN03 пассивирует некоторые металлы. Еще Ломоносов открыл, что железо, легко растворяющееся в разбавленной азотной кислоте, не растворяется в холодной концентрированной HN03. Позже было установлено, что аналогичное действие азотная кислота оказывает на хром и алюминий. Эти металлы переходят под действием концентрированной азотной кислоты в пассивное состояние (см. § 100).
Степень окисленности азота в азотной кислоте равна -f-5. Выступая в качестве окислителя, HN03 может восстанавливаться до различных продуктов:
+ IV +ш +п +i о -ш
N02 N203 NO N20 N2 NH4Nr03
Какое из этих веществ образуется, т. е. насколько глубоко восстанавливается азотная кислота в том или ином случае, зависит от природы восстановителя и от условий реакции, прежде всего от концентрации кислоты. Чем выше концентрация HN03, тем менее глубоко она восстанавливается. При реакциях с концентрированной кислотой чаще всего выделяется NO2. При взаимодействии разбавленной азотной кислоты с малоактивными металлами, например, с медью, выделяется N0. В случае более активных металлов— железа, цинка — образуется N20. Сильно разбавленная азотная кислота взаимодействует с активными металлами — цинком, магнием, алюминием — с образованием иона аммония, дающего с кислотой нитрат аммония. Обычно одновременно образуются несколько продуктов.
Для иллюстрации приведем схемы реакций окисления некоторых металлов азотной кислотой *:
Си + ЫШз (конц.) —► Cu(N03)2 + N02f + Н20 Си + KN03 (разбавл.) —> Си (N03)2 + NOf + Н20 Mg + HN03 (разбавл.) —> Mg(N03)2 + N2Of + H20 Zn + HN03 (очень разбавл.) —> Zn (N03)2 + NH4N03 + H20
При действии азотной кислоты на металлы водород, как правило, не выделяется.
При окислении неметаллов концентрированная азотная, кисло-Зла, как и в случае металлов, восстанавливается до NO2, например
S + 6HN03 = H2S04 + 6N02| + 2Н20
Более разбавленная кислота обычно восстанавливается до N0, Например:
ЗР + 5HN03 + 2Н20 = ЗН3Р04 + 5NOf
Приведенные схемы иллюстрируют наиболее типичные случаи взаимодействия азотной кислоты с металлами и неметаллами. Вообще же, окислительно-восстановительные реакции, идущие с участием HN03, протекают сложно.
Смесь, состоящая из 1 объема азотной и 3—4 объемов концентрированной соляной кислоты, называется царской водкой. Царская водка растворяет некоторые металлы, не взаимодействующие с азотной кислотой, в том числе и «царя металлов» — золото. Действие ее объясняется тем, что азотная кислота окисляет соляную с выделением свободного хлора и образованием хлороксида азо-та(Ш), или хлорида нитрозила, NOC1:
HN03 + ЗНС1 = С12 + 2Н20 ++N0C1
Хлорид нитрозила является промежуточным продуктом реакции и разлагается:
2NOC1 = 2NO + С12
Хлор в момент выделения состоит из атомов, что и обусловливает высокую окислительную способность царской водки. Реакции окисления золота и платины протекают в основном согласно следующим уравнениям:
| * Учащемуся рекомендуется самому составить полные уравнения этих реакций, |
Au + HN03 + ЗНС1 = AuCl3 + NOf + 2H20 3Pt + 4HN03 + 12HC1 = 3PtCl4 + 4NOf + 8H20
С избытком соляной кислоты хлорид золота (III) и хлорид пла> тины (IV) образуют комплексные соединения Н [АиСЦ] иН2[РЮ6].
На многие органические.вещества азотная кислота действует так, что один или несколько атомов водорода в молекуле органического соединения замещаются нитрогруппами — N02. Этот процесс называется нитрованием и имеет большое значение в органической химии.
Электронная структура молекулы HNO3 рассмотрена в § 44.
Азотная кислота — одно из важнейших соединений азота: в больших количествах она расходуется в производстве азотных удобрений, взрывчатых веществ и органических красителей, служит окислителем во многих химических процессах, используется в производстве серной кислоты по нитрозному способу, применяется для изготовления целлюлозных лаков, кинопленки.
Соли азотной кислоты называются нитратами. Все они хорошо растворяются в воде, а при нагревании разлагаются с выделением кислорода. При этом нитраты наиболее активных металлов переходят в нитриты:
2КМ03 = 2KN02 + 02f
Нитраты большинства остальных металлов при нагревании распадаются на оксид металла, кислород и диоксид азота. Например:
2Cu(N03)2 = 2CuO + 4N02f + 02f
Наконец, нитраты наименее активных металлов (например, серебра, золота) разлагаются при нагревании до свободного металла:
2AgNOj = 2Ag + 2N02f + 02f
Легко отщепляя кислород, нитраты при высокой температуре являются энергичными окислителями. Их водные растворы, напротив, почти не проявляют окислительных свойств.
Наиболее важное значение имеют нитраты натрия, калия, аммония и кальция, которые на практике называются селитрами.
Нитрат натрия NaN03, или натриевая селитра, иногда называемая также чилийской селитрой, встречается в большом количестве в природе только в Чили.
Нитрат калия KN03, или калийная селитра, в небольших количествах также встречается в природе, но главным образом получается искусственно при взаимодействии нитрата натрия с хлоридом калия.
Обе эти соли используются в качестве удобрений, причем нитрат калия содержит два необходимых растениям элемента: азот и калий. Нитраты натрия и калия применяются также при стекловарении и в пищевой промышленности для консервирования продуктов.
Нитрат кальция Ca(N03)2, или кальциевая селитра, получается в больших количествах нейтрализацией азотной кислоты известью; применяется как удобрение.
Нитрат аммония IMH4NO3 — см. стр. 390.
143. Промышленное получение азотной кислоты. Современные
промышленные способы получения азотной кислоты основаны на
каталитическом окислении аммиака кислородом воздуха. При опи-
сании свойств аммиака (см. § 137) было указано, что он горит
в кислороде, причем продуктами реакции являются вода и свобод-
ный азот. Но в присутствии катализаторов окисление аммиака
кислородом может протекать иначе. Если пропускать смесь ам-
миака с воздухом над катализатором, то при 750°С и определен-
ном составе смеси происходит почти полное превращение NH3
в N0:
4NH3 + 502 = 4NO + 6Н20 +907 кДж
Образовавшийся NO легко переходит в N02, который с водой в присутствии кислорода воздуха дает азотную кислоту (см. § 140).
В качестве катализаторов при окислении аммиака используют сплавы на основе платины.
Получаемая окислением аммиака азотная кислота имеет концентрацию, не превышающую 60%. При необходимости ее концентрируют.
Промышленностью выпускается разбавленная азотная кислота концентрацией 55, 47 и 45%, а концентрированная — 98 и 97%. Концентрированную кислоту перевозят в алюминиевых цистернах, разбавленную — в цистернах из кислотоупорной стали.
144. Круговорот азота в природе. При гниении органических
веществ значительная часть содержащегося в них азота превра-
щается в аммиак, который под влиянием живущих в почве нит-
рифицирующих бактерий окисляется затем в азотную кис-
лоту. Последняя, вступая в реакцию с находящимися в почве
карбонатами, например с карбонатом кальция СаС03, образует
нитраты;
2HN'03 + СаСОз = Ca(N03)2 + С02 + Н20
Некоторая же часть азота всегда выделяется при гниении в свободном виде в атмосферу. Свободный азот выделяется также при горении органических веществ, при сжигании дров, каменного угля, торфа. Кроме того, существуют бактерии, которые при недостаточном доступе воздуха могут отнимать кислород от нитратов, разрушая их с выделением свободного азота. Деятельность этих денитрифицирующих бактерий приводит к тому, что часть азота из доступной для зеленых растений формы (нитраты) переходит в недоступную (свободный азот). Таким образом, далеко не весь азот, входивший в состав погибших растений, возвращается обратно в почву, часть его постепенно выделяется в свободном виде.
Непрерывная убыль минеральных азотных соединений давно должна была бы привести к полному прекращению жизни на Земле, если бы в природе не существовали процессы, возмещающие потери азота. К, таким процессам относятся прежде всего происходящие в атмосфере электрические разряды, при которых всегда образуется некоторое количество оксидов азота; последние с водой дают азотную кислоту, превращающуюся в почве в нитраты. Другим источником пополнения азотных соединений почвы является жизнедеятельность так называемых азотобактерий, способных усваивать атмосферный азот. Некоторые из этих бактерий поселяются на корнях растений из семейства бобовых, вызывая образование характерных вздутий—«клубеньков», почему они и получили название клубеньковых бактерий. Усваивая атмосферный азот, клубеньковые бактерии перерабатывают его в азотные соединения, а растения, в свою очередь, превращают по--следние в белки и другие сложные вещества.
Таким образом, в природе совершается непрерывный круговорот азота. Однако ежегодно с урожаем с полей убираются наиболее богатые белками части растений, например зерно. Поэтому в почву необходимо вносить удобрения, возмещающие убыль в ней важнейших элементов питания растений.
Изучение вопросов питания растений и повышения урожайности последних путем применения удобрений является предметом специальной отрасли химии, получившей название агрохимии. Большой вклад в развитие этой науки внесен французским ученым Ж. Б. Буссенго (1802—1887), немецким химиком Ю. Либихом (1803—1873) и русским ученым Д. Н. Прянишниковым*.
ФОСФОР (PHOSPHORUS)
145. Фосфор в природе. Получение и свойства фосфора. Фосфор принадлежит к числу довольно распространенных элементов; содержание еговземной коре составляет около 0,1 % (масс.). Вследствие легкой окисляемости фосфор в свободном состоянии в природе не встречается.
| * Дмитрий Николаевич Прянишников (1865—1948) — академик, Герой Социалистического Труда, лауреат Ленинской и Государственных премий, основоположник и руководитель советской школы агрохимиков. Автор многочисленных научных трудов, в том числе по вопросам азотного питания растений. |
Из природных соединений фосфора самым важным является ортофосфат кальция Са3(Р04)2, который в виде минерала фосфорита иногда образует большие залежи. В СССР богатейшие месторождения фосфоритов находятся в Южном Казахстане в горах Каратау. Часто встречается также минерал апатит, содержащий, кроме Са3(Р04)г, еще CaF2 или СаС12. Огромные залежи апатита были открыты в двадцатых годах нашего столетия на Кольском полуострове. Это месторождение по своим запасам самое большое в мире.
Фосфор, как и азот, необходим для всех живых существ, так как он входит в состав некоторых белков как растительного, так и животного происхождения. В растениях фосфор содержится главным образом в белках семян, в животных организмах — в белках молока, крови, мозговой и нервной тканей» Кроме того, большое количество фосфора содержится в костях позвоночных животных в основном в виде соединений ЗСаз(Р04)2-Са(ОН)2 и ЗСа3(Р04)2-СаСОз-Н20. В виде кислотного остатка фосфорной кислоты фосфор входит в состав нуклеиновых кислот — сложных органических полимерных соединений, содержащихся во всех живых организмах. Эти кислоты принимают непосредственное участие в процессах передачи наследственных свойств живой клетки.v
Сырьем для получения фосфора и его соединений служат фосфориты и апатиты. Природный фосфорит или апатит измельчают, смешивают с песком и углем и накаливают в печах с помощью электрического тока без доступа воздуха.
Чтобы понять происходящую реакцию, представим фосфат кальция как соединение оксида кальция с фосфорным ангидридом (ЗСа0-Р205); песок же состоит в основном из диоксида кремния Si02. При высокой температуре диоксид кремния вытесняет фосфорный ангидрид и, соединяясь с оксидом кальция, образует лeгкoплaвкийvсиликат кальция CaSi03, а фосфорный ангидрид восстанавливается углем до свободного фосфора:
Са3(Р04)2 + 3Si02 = 3CaSi03 + P2Os Р205 + 5С = 2Р + 5СО
Складывая оба уравнения, получаем:
Са3(Р04)2 + 3Si02 + 5С = 3CaSi03 + 2Р + 5СО
Фосфор выделяется в виде паров, которые конденсируются в приемнике под водой.
Фосфор образует несколько аллотропических видоизменений.
Белый фосфор получается в твердом состоянии при бьгстром охлаждении паров фосфора; его плотность 1,83 г/см3.^'' чистом виде белый фосфор совершенно бесцветен и прозрачен; продажный продукт обычно окрашен в желтоватый цвет и по внешнему виду похож на воск. На холоду белый фосфор хрупок, но при температуре выше 15 °С становится мягким и легко режется ножом.
На воздухе белый фосфор очень быстро окисляется и при этом светится в темноте. Отсюда произошло название «фосфор», которое в переводе с греческого означает «светоносный». Уже при слабом нагревании, для чего достаточно простого трения, фосфор воспламеняется^и сгорает, выделяя большое количество теплоты. Фосфор может и самовоспламениться на воздухе вследствие выдел
ления теплоты при окислении/Чтобы защитить белый фосфор от окисления, его сохраняют под водой^В воде белый фосфор нерастворим; хорошо растворяется в сероуглероде.
Белый фосфор имеет молекулярную кристаллическую решетку, в узлах которой находятся тетраэдрические молекулы Р4. Прочность связи между атомами в этих молекулах сравнительно невелика. Это объясняет высокую химическую активность белого фосфора.
Белый фосфор — сильный яд, даже в малых дозах действую' { щий смертельно.
Если белый фосфор долго нагревать без доступа воздуха при 250—300 °С, то он превращается в другое видоизменение фосфора, имеющее красно-фиолетовый цвет и называемое красным фосфором. Такое же превращение происходит, но только очень медленно, под действием света.
Красный фосфор по своим свойствам резко отличается от белого: он очень медленно окисляется на воздухе, не светится в темноте, загорается только при 260 °С, не растворяется в сероуглероде и неядовит. Плотность красного фосфора составляет 2,0— 2,4 г/см3. Переменное значение плотности обусловлено тем, что красный фосфор состоит из нескольких форм. Их структура не вполне выяснена, однако известно, что они являются полимерными веществами.
При сильном нагревании красный фосфор, не плавясь, испаряется (сублимируется). При охлаждении паров получается белый фосфор.
Черный фосфор образуется из белого при нагревании его до 200—220 °С под очень высоким давлением. По виду он похож на графит, жирен на ощупь и тяжелее других видоизменений; его плотность равна 2,7 г/см3. Черный фосфор — полупроводник.
Применение фосфора весьма разнообразно. Большое количество его расходуется па производство спичек.
При изготовлении спичек применяется красный фосфор; он содержится в массе, которая наносится па спичечную коробку. Головка же спички состоит из смеси горючих веществ с бертолетовой солью и соединениями, катализирующими распад соли (Mn02, Fe203 и др.)
Кроме спичечного производства, фосфор применяется в металлургии. Он используется для получения некоторых полупроводников— фосфида галлия GaP, фосфида индия InP. В состав других полупроводников он вводится в очень небольших количествах в качестве необходимой добавки. Кроме того, он входит в состав некоторых металлических материалов, например оловянистых бронз.
При горении фосфора образуется густой белый дым; поэтому белым фосфором снаряжают боеприпасы (артиллерийские снаряды, авиабомбы и др.), предназначенные для образования дымовых завес. Большое количество фосфора идет на производство фосфорорганических препаратов, к числу которых относятся весьма эффективные средства уничтожения насекомых-вредителей.^/
Свободный фосфор чрезвычайно активен. Он непосредственно взаимодействует со многими простыми веществами с выделением большого количества теплоты. Легче всего фосфор соединяется с кислородом, затем с галогенами, серой и со многими металлами, причем в последнем случае образуются фосфиды, аналогичные нитридам, — например Са3Р2, Mg3P2 и др. Все эти свойства особенно резко проявляются у белого фосфора; красный фосфор реагирует менее энергично, черный вообще с трудом вступает в химические взаимодействия.
146. Соединения фосфора с водородом и галогенами. С водородом фосфор образует газообразный фосфористый водород, или фосфин, РН3. Его можно получить кипячением белого фосфора с раствором щелочи или действием соляной кислоты на фосфид кальция Са3Р2:
Са3Р2 + 6НС1 = ЗСаС12 + 2PH3f
Фосфин — бесцветный газ с чесночным запахом, очень ядовитый*. При его горении образуются фосфорный ангидрид и вода:
2РН3 + 402 = Р205 + ЗН20
Основные свойства выражены у фосфина слабее, чем у аммиака. Он образует соли только с наиболее сильными кислотами, например НС104, НС1. В этих солях катионом является ион^фосфо-ния РН44". Примером может служить хлорид фосфония РН4С1. Соли фосфония — очень непрочные соединения; при взаимодействии с |водой они разлагаются на галогеноводород и фосфин. L Фосфор непосредственно соединяется со всеми галогенами с выделением большого количества теплоты. Практическое значение имеют главным образом соединения фосфора с хлором. ~ Хлорид фосфора(\\\), или треххлористый фосфор, РС13 получается при пропускании хлора над расплавленным фосфором. Он представляет собой жидкость, кипящую при 75 °С.
При действии воды РС13 полностью гидролизуется с образованием хлороводорода и фосфористой кислбты Н3Р03:
РС13 + ЗН20 = Н3РО3 + ЗНС1
| * Одновременно с фосфином иногда образуется небольшое количество жидкого дифосфина Р2Н4, пары которого самовоспламеняются на воздухе, |
При пропускании хлора в треххлористый фосфор получается хлорид фосфора(У), или пятихлористый фосфор, РС15, который при обычных условиях образует твердую белую массу. Пятихлористый фосфор тоже разлагается водой с образованием хлороводорода и фосфорной кислоты. Аналогичные соединения фосфор образует с бромом, иодом и фтором; однако для иода соединение состава PI5 неизвестно.
Хлориды фосфора применяются при синтезах различных органических веществ.
147. Оксиды и кислоты фосфора. К важнейшим оксидам фосфора принадлежат Р203 и Р205.
Оксид фосфора(\\\), или фосфористый ангидрид, Р203 получается при медленном окислении фосфора или когда фосфор сгорает при недостаточном доступе кислорода. Это белые кристаллы, плавящиеся при 23,8 °С. Молекулярная масса его при низких температурах соответствует формуле Р40б. При действии холодной воды оксид фосфора(Ш) медленно взаимодействует с ней, образуя фосфористую кислоту Н3Р03. Как оксид фосфора(III), так и фосфористая кислота обладают сильно выраженными восстановительными свойствами.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 428; Нарушение авторских прав?; Мы поможем в написании вашей работы!