
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Характеристика вагонов 81-717(714) 24 страница
|
|
|
|
бутадиен
Изопрен может быть получен дегидрированием изопентана:
СНз СНз
СН2
-СН-
■СН2-СН3
катализатор
-> сн2=с—сн=сн2
—2112
изопеитан изопрен
Важным источником получения этилена и его гомологов служат газообразные и жидкие продукты крекинга углеводородов нефти. Крекингом называют процесс расщепления углеводородов с длинными цепями на молекулы меньшей длины, происходящий в присутствии катализаторов (каталитический крекинг) или при нагревании предельных углеводородов до 500—700 °С под давлением (термический крекинг). Например:
СНз—СН2—СН2—СНз —> CH3-CH3 + сн2=сн2
бутан этан этилен
| СН, |
| -(СН2)4-гексан |
СНз—(СН2)2—СНз + сн2=сн2
-СН, — бутан
СН3—СН2—СНз + СН2=СН—СНз
| * См. примечание на стр. 455, |
пропан пропилеи
Крекинг нефтяных продуктов позволяет получать смеси низко-кипящих углеводородов (например, бензин) из углеводородов с высокой температурой кипения. При крекинге наряду с предельными углеводородами всегда получаются и непредельные. Непредельные углеводороды, образующиеся при крекинге, а также полученные дегидрированием предельных углеводородов, содержащихся в попутных газах нефтедобычи, все шире используются в промышленности органического синтеза в качестве сырья для производства пластических масс, химических волокон, спиртов, каучукоподобных материалов, моющих средств, растворителей и других ценных продуктов.
Физические свойства этиленовых и ацетиленовых углеводородов в гомологических рядах изменяются с той же закономерностью, как и у предельных: низшие представители — газы, более сложные— жидкости, а затем — вещества с постепенно возрастающими температурами плавления и кипения, находящиеся при обычных условиях в твердом состоянии.
По химическим свойствам непредельные углеводороды резко отличаются от предельных; они исключительно реакционноспособ-ны и вступают в разнообразные реакции присоединения. Такие реакции происходят путем присоединения атомов или групп атомов к атомам углерода, связанным двойной или тройной связью. При этом кратные связи довольно легко разрываются и превращаются в простые.
Так, этилен и ацетилен легко присоединяют бром, переходя в соответствующие ди- и тетрагалогенпроизводные:
СН2=СН2 + Вг2 —> СН2Вг— СН2Вг
этилен дибромэтаи
+ Вг2 +Вг2
СН^СН -------- > СНВг=СНВг ----------- > СИВг2—СНВг2
ацетилен дибромэтилен тетрабромэтан
Реакция может служить для обнаружения непредельных углеводородов — бурая окраска брома быстро исчезает.
Другой качественной реакцией на наличие кратных связей служит окисление перманганатом калия: непредельные соединения окисляются очень легко с разрывом кратных связей, а фиолетовая окраска КМп04 при этом исчезает.
Важным свойством непредельных углеводородов является способность их молекул соединяться друг с другом или с молекулами других непредельных углеводородов (реакция полимеризации, § 177).
Этилен С2Н4 — бесцветный газ со слабым приятным запахом, довольно хорошо растворимый в воде. Его температура кипения — 103,8°С, температура затвердевания —-169,5 °С. На воздухе он горит слегка светящимся пламенем.
Этилен — весьма важное сырье для получения ряда синтетических продуктов, особенно этилового спирта, этиленоксида (окиси этилена), этиленгликоля (антифриз), полиэтилена (см. § 177) идр.
Ацетилен С2Н2— б&сцветный газ с характерным слабым запахом; температура кипения —-83,8°С, температура затвердевания —-80,8 °С. Технический ацетилен, получаемый из карбида кальцнл, пахнет неприятно нз-за имеющихся в нем примесей. На воздухе ацетилен горит сильно коптящим пламенем. При его сгорании выделяется большое количество теплоты. Поэтому ацетилен в смеси с кислородом широко используют для сварки и резки металлов (автогенная сварка; температура пламени до 3350 °С). Взрывоопасен; смеси с воздухом, содержащие от 2,3 до 80,7 % ацетилена, взрывают от искры. Трудно растворим в воде; под небольшим давлением (1,2—1,5 МПа) хорошо растворяется в ацетоне (до 300 объемов) и в таком виде безопасен.
Действие воды на карбид кальция СаС2 до сих пор остается одним из распространенных способов получения ацетилена:
CaC2-f2H20 СНг=СН + Са(ОН)2
Новый, современный метод получения ацетилена заключается в пиролизе (превращение пои высоких температурах) углеводородов, главным образом метана:
1530 °С
2СН4 ■ >■ CIL=CH+3H2
Ацетилен, подобно этилену, — ценное химическое сырье. Из него получают уксусный альдегид, этиловый спирт, уксусную кислоту, синтетические каучуки, пластические массы и другие продукты.
В области непредельных, а особенно ацетиленовых углеводородов большое значение имеют исследования, проведенные А. Е. Фаворским (1860—1945) и его учениками. Фаворский открыл большое число различных перегруппиронок молекул при химических реакциях и показал, как можно управлять этими процессами.
| * По систематической номенклатуре ИЮПАК -т циклоалканами, |
166. Предельные циклические углеводороды. В 80-х годах XIX века В. С. Марковников показал, что в отличие от американской нефти бакинская нефть содержит главным образом циклические углеводороды, имеющие пять или шесть атомов углерода в цикле. В молекулах этих углеводородов атомы углерода соединены простыми связями, как и в молекулах предельных углеводородов с открытой цепью — парафинов, что делает их сходными по свойствам с предельными углеводородами. Поэтому теперь такие циклические углеводороды называют циклопарафинами*. Они относятся к алициклическим соединениям (см. § 163).
167. Ароматические углеводороды
Примерами циклопарафинов могут служить: СН,
I сн2 СН2
н2с—сн2 н2с—сн н2с \сн2 н2с^ \сн—сн2—сн3
II I I II II
Н2С\ /СН2 Н2С\ /СН2 Н2С\ /СН2 Н2С\ /СН-СН3
СН2 СН2 СН2 СИ»
цпклопептан мгтнлциклопоптан цнклогексан метнлэтнлциклогексан
167. Ароматические углеводороды. Очень важную группу образуют циклические углеводороды ароматического ряда; простейшими из них являются бензол СбНв и его гомологи, например толуол (метилбензол) С6Н5—СН3 и этилбензол CsHs—СН2СН3, состав которых отвечает общей формуле С„Н2„_6, а строение обычно выражают структурными формулами:
СН СН /СН3 СН /СН2—СН3
НС^ \сы нс^ \с' нс^ \с/
I II I II I II
НС^ /СН НС^ /СН НС^ /СН
СН СН СН
бензол CgHg толуол С7Н8 этплогнзол Cg4\o
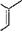
|
|
Во всех этих соединениях содержится особая циклическая группировка из шести атомов углерода — бензольное ароматическое ядро. Структурная формула бензольного ядра с чередующимися тремя двойными и тремя простыми связями была предложена еще в 1865 г. немецким химиком А. Кекуле. Для простоты написания бензольное ядро изображают упрощенно в виде шестиугольника, в котором символы С и Н, относящиеся к кольцу, не пишут:
с "
| Одновалентный радикал бензола CsHs— или v х>—, образую |
бензол толуол
щийся при отнятии атома водорода от любого углеродного атома бензольного ядра, называется фенилом.
Известны ароматические углеводороды с кратными связями в боковых цепях, например стирол, а также многоядерные, содержащие несколько бензольных ядер, например нафталин и антра' цен:
СН /СН=СН2 сн СН СН СН СН
HCs^ \с/ НС^ 5^СН НС^ MX 5^С^ ^СН
I II I II 1 I I I I
НС^ ХСН НСг^ /С\ г^СН НС5^ /С\ ^С\ ^СН
СН СН СН СН СН СН
стирол CsHs нафталин С^Нв антрацен с14н10
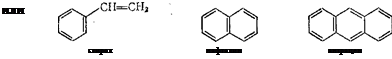
'Ароматические углеводороды содержатся в каменноугольной смоле, получаемой при коксовании каменного угля. Другим важным источником их получения служит нефть некоторых месторождений, например Майкопского. Чтобы удовлетворить огромную Потребность в ароматических углеводородах, их получают также цутем каталитической ароматизации ациклических углеводородов нефти.
Эта проблема была успешно разрешена Н. Д. Зелинским и его
учениками Б. А. Казанским и А. Ф. Платэ, осуществившими пре-
вращение многих предельных углеводородов в ароматические. Так,
Из гептана C7Hi6 при нагревании в присутствии катализатора по-
лучается толуол: v v '
СН2 СН /СН3
Н2С^ \СН2—СН3 Р. 310 ос НС^ \с/
I —---»- I || +4Н2
Н2С\ /-СНз НС^ /СН
СН2 СН
гептан толуол
Ароматические углеводороды и их производные широко применяют для получения пластических масс, синтетических красителей, лекарственных и взрывчатых веществ, синтетических каучу-ков, моющих средств.
Бензол и все соединения, содержащие ядро бензола, названы ароматическими (в начале XIX века), поскольку первыми изученными представителями этого ряда были душистые вещества или соединения, выделенные из природных ароматных веществ. Теперь к этому ряду относят и многочисленные соединения, не имеющие приятного запаха, но обладающие комплексом химических свойств, называемых ароматическими свойствами.
Бензол — бесцветная жидкость с характерным запахом; температура кипения 80,1 °С, температура плавления 5,5°С. Ароматические свойства бензола, определяемые особенностями его структуры, выражаются в относительной устойчивости бензольного ядра, несмотря на непредельность бензола по составу. Так, в отличие от непредельных соединений с этиленовыми двойными связями, бензол устойчив к действию окислителей; например, подобно предельным углеводородам, он не обесцвечивает раствор перманганата калия. Реакции присоединения для бензола не характерны, наоборот, для него, как и для других ароматических соединений, характерны реакции замещения атомов водорода в бензольном, ядре. Ниже приведены важнейшие из таких реакций, •
Реакция галогенирования. При действии брома или хлора (в присутствии катализаторов) образуются галоге и производи ы е:
г^ВГ • Вг2 —> Г || + НВг
бромбензол
Реакция сульфирования. При действии концентрированной серной кислоты (при нагревании) образуются сульфо-кислот ы:
 | |||
 | |||

— SOjOH
S02OH
+ н2о
серная кислота
бензолсульфо-кислота
Реакция нитрования. При действии концентрированной азотной кислоты (в присутствии концентрированной H2SO4) образуются нитросоединения:

| +:Н0 |
!Н
—N02
+ н2о
азотная кислота
нитробензол
Нитрованием толуола получают взрывчатое вещество — тринитротолуол (тротил, или гол):
СН.
02N.
N02
N02
Многие другие ароматические п о л и и и т р ос о е д и н е н и я (содержащие три и более нитрогрупп — N02) также используются как взрывчатые вещества. Нитросоединения могут быть восстановлены в амины (§ 175).
Из сказанного следует, что формула бензола в виде цикла с чередующимися двойными и простыми связями (формула Ке-куле) неточно выражает природу связей между атомами углерода в бензольном ядре. В соответствии с этой формулой в бензоле должно быть три локализованных л-связи, т. е. три пары л-элек-тронов, каждая из которых фиксирована между двумя атомами
углерода — схема (1); если обозначить эти я-электроны точками, то строение бензола следует представить схемой (2);
н к л
,А-%, нЛЛя л^.
!! I
И II н
<1) <г> (3)
Однако опыт показывает, что в кольце бензола кет обычных двойных связей, чередующихся с простыми, и что все связи между С-атомами в бензоле равноценны. Длина каждой из них (0,140 им) имеет промежуточное значение по сравнению с длиной простой связи С—С (0,154 им) и этиленовой двойной связи С=С (0,134 нм) в других (неароматических) органических соединениях.
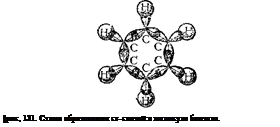 Каждый из атомов углерода в кольце бензола находится в состоянии 5,о2-гибрндизацип и затрачивает по три валентных электрона на образование а-связей с двумя соседними атомами углерода и с одним атомом водорода. При этом все шесть атомов углерода и все а-связи С—С и С—Н лежат в одной плоскости (рис. 131). Облако четвертого валентного электрона каждого из атомов углерода (т. е. облако р-электрона, не участвующего в гибридизации) имеет форму объемной восьмерки («гантели») и ориентировано перпендикулярно плоскости бензольного кольца. Каждое из таких р-электронных облаков перекрывается над и под плоскостью кольца с р-электронными облаками двух соседних атомов углерода. Это показано иа рис. 132, а и, в проекции, на рис. 132,6. Плотность облаков jt-электроков в бензоле равномерно распределена между всеми связями С—С. Иначе говоря, шесть я-электропов обобщены всеми углеродными атомами кольца и образуют единое кольцевое облако (ароматический электронный секстет). Так объясняется равноценность (выравнешюсть) ароматических связей, обусловливающих характерные (ароматические)' свойства бензольного ядра. Равномерное распределение облака я-электронов и выравыенность связей в бензоле иногда изобра-
Каждый из атомов углерода в кольце бензола находится в состоянии 5,о2-гибрндизацип и затрачивает по три валентных электрона на образование а-связей с двумя соседними атомами углерода и с одним атомом водорода. При этом все шесть атомов углерода и все а-связи С—С и С—Н лежат в одной плоскости (рис. 131). Облако четвертого валентного электрона каждого из атомов углерода (т. е. облако р-электрона, не участвующего в гибридизации) имеет форму объемной восьмерки («гантели») и ориентировано перпендикулярно плоскости бензольного кольца. Каждое из таких р-электронных облаков перекрывается над и под плоскостью кольца с р-электронными облаками двух соседних атомов углерода. Это показано иа рис. 132, а и, в проекции, на рис. 132,6. Плотность облаков jt-электроков в бензоле равномерно распределена между всеми связями С—С. Иначе говоря, шесть я-электропов обобщены всеми углеродными атомами кольца и образуют единое кольцевое облако (ароматический электронный секстет). Так объясняется равноценность (выравнешюсть) ароматических связей, обусловливающих характерные (ароматические)' свойства бензольного ядра. Равномерное распределение облака я-электронов и выравыенность связей в бензоле иногда изобра-
Н
Тк g^H
\6 6|
н-^ ^cr Nt
Iй
н

жают формулой (3) (стр. 462)'. Соответственно, вместо общепринятого символа бензольного ядра в виде шестиугольника с чередующимися двойными и простыми связями, отвечающего формуле Кекуле (1а), бензол изображают шестиугольником с кружочком внутри (За):
(1а)
(За)
На рис. 133 представлена сегментовая модель молекулы бензола.
С течки зрения метода наложения валентных схем структуру молекулы
бензола, представленную формулой (3), следует рассматривать как промежу-
точную между двумя возможными структурами бензола, выражаемыми фор-
мулами Кею/лс:
Н II
! I
Нч С Л-1 Нч С /Н
му хс/ ^с/
W с хн
и
W с
I
ы
Поскольку в молекуле бензола три электронные пары являются общими для вес.; шести атомов углерода бензольного кольца, образуемые ими езязп — шестицептровые (см, § 44).
168. Галогенпроизводкые углеводородов. Галогенпроизводиыми называют соединения, которые можно рассматривать как продукты замещения одного или нескольких атомов водорода в молекуле углеводорода атомами галогенов. Ниже приведены примеры соединений этого класса.
Метилендихлорид СН2С12 (хлористый метилен, дихлорметан)—> жидкость (темп, кип, 40,1 °С); применяется как растворитель.
'Хлороформ СНСЬ (трихлорметан)—жидкость (темп. кип. 61,2 °С); применяется для наркоза при хирургических операциях и как растворитель.
Четыреххлористый углерод ССЦ (тетрахлорметан)—тяжелая негорючая жидкость (темп. кип. 76,8°С); применяется как растворитель при извлечении жиров и масел из растений, для удаления Жировых пятен с тканей, в огнетушителях.
Дифтордихлорлетан CF2CI2 (фреон-12)—жидкость с температурой кипения 29,8 °С. Не ядовит, не реагирует при комнатной.температуре с металлами. При его испарении поглощается большое количество теплоты. Применяется (как и другие фреоны — Ьолифторхлоруглеводороды) в холодильных устройствах, а также как растворитель для образования аэрозолей.
: Винилхлорид СН«=СН—С1 (хлористый винил) — производное этилена. Бесцветный газ. Получается присоединением хлороводо-рода к ацетилену. Легко полимеризуется, применяется для получения поливинилхлорида (стр. 486).
Тетрафторэтилен CF2=CF2 — бесцветный газ. Получается пиролизом фреона-22 (CHF2C1). Применяется для получения фторопласта (стр. 486).
Некоторые галогенпроизводные углеводородов входят в состав ядохимикатов* — химических средств для борьбы с вредными насекомыми (инсектициды) и грибками, поражающими растения (фунгициды).
169. Спирты и фенолы. Спирты — производные предельных или непредельных углеводородов, в молекулах которых один или несколько атомов водорода заменены гидроксильными группами**. Так, метиловый спирт (метанол) СН3—ОН представляет собой гидроксильное производное метана СН4, этиловый спирт (этанол) СН3—СН2—ОН — производное этана СН3—СН3. Производные ароматических углеводородов с группой ОН в бензольном ядре называются фенолами. Так, фенол СвН$—ОН (или
•—он)— производное бензола С6Нб — простейший предста
витель класса фенолов.
| * Значение ядохимикатов огромно, особенно для сельского хозяйства. Достаточно указать, что потери урожая от вредителей и болезней растений достигают 20 % и более. Поэтому в планах развития народного хозяйства в нашей стране постоянно предусматривается значительное увеличение производства и расширение ассортимента химических средств защиты растений. ** К спиртам относятся также производные циклопарафинов (например, циклогексанол С6НцОН — производное циклогексана С6Н12), а также производные ароматических углеводородов, содержащие группу ОН не в бензольном ядре, а в боковой цепи (например, ароматический бензиловый спирт С6Н3—. СН2—ОН — производное толуола C6Hs—СНз), |
Подобно молекулам воды (см. § 70), молекулы низших спиртов связываются между собой водородными связями. Поэтому они представляют собой ассоциированные жидкости и имеют более
высокие температуры кипения, чем углеводороды, производными которых они являются, и чем другие органические вещества с таким же составом и молекулярной массой, но не содержащие гидр-оксильных групп. Фенолы при обычных условиях находятся, как правило, в кристаллическом состоянии.
Общим свойством спиртов и фенолов является подвижность водорода гидроксильной группы. Так, при действии на спирт щелочного металла этот водород вытесняется металлом и получаются твердые, растворимые в спирте соединения, называемые алко-голятами, например:
2СН3—СН2—ОН + 2Na —>■ 2СН3—СН2—ONa + H2f
этиловый спирт алкоголят
(этилат) натрия
Формально такая реакция напоминает образование солей из кислот, однако алкоголяты подобны солям очень слабых кислот и нацело гидролизуются водой; при этом снова образуются спирт и щелочь:
СН3—СН2—ONa + Н20 —> СН3—СН2—OH + NaOH
Поэтому при взаимодействии спиртов с водными растворами щелочей алкоголяты не образуются.
В фенолах под влиянием ароматического бензольного ядра подвижность водорода гидроксильной группы выше. Они образуют металлические производные — феноляты — не только при действии щелочных металлов, но, в отличие от спиртов, и при действии щелочей:
---- ОН + NaOH —> —ONa + H20
фенол фенолят натрия
Феноляты в отличие от алкоголятов водой не разлагаются, но все же и они в водных растворах, подобно солям слабых кислот и сильных оснований, частично гидролизованы и их растворы имеют щелочную реакцию. Фенол вытесняется из фенолята даже угольной кислотой.
Спирты практически не являются электролитами. Константа диссоциации этилового спирта близка к Ю-'8, тогда как константа диссоциации воды — к 30~16, т. е. этиловый спирт является более слабой кислотой, чем вода. Константа диссоциации фенола несколько выше (1,3-10-!0).
Спирты и фенолы взаимодействуют с кислотами, образуя сложные эфиры, например
СН,—О—:"н"+Но";—NOj СН,—О—N02 + Н20
метиловый спирт
азотная кислота
метиловый эфир азотной кислоты (метилнитрат)
Особый интерес представляют сложные эфиры спиртов и фенолов с органическими кислотами (см. § 173).
Спирты значительно легче окисляются, чем соответствующие углеводороды. При этом образуются альдегиды пли кетоны (см. § 171).
Метиловый спирт, или метанол, СН3ОН — бесцветная жидкость (темп. кип. 64,5 °С). Весьма ядовит: прием небольших доз его внутрь вызывает слепоту, а больших —• смерть. Метиловый спирт получают в больших количествах синтезом из оксида углерода (II) и водорода при высоком давлении (20—30 МПа) и высокой тем-пеоатуре (400°С) в присутствии катализатора (около 90 % ZnO и 10 % Сг203):
СО + 2Н2 5=>г СН3ОН
Метиловый спирт образуется и при сухой перегонке дерева; поэтому его называют также древесным спиртом. Применяется он как растворитель, а также для получения других органических веществ.
Этиловый (винный) спирт, или этанол, СН3СН2ОН (темп. кип. 78,4 °С) ■—одно из важнейших исходных веществ в современной промышленности органического синтеза. Для получения его издавна пользуются различными сахаристыми веществами, например виноградным сахаром, или глюкозой, которая путем «брожения», вызываемого действием ферментов (энзимов), вырабатываемых дрожжевыми грибками, превращается в этиловый спирт. Реакция протекает согласно схеме:
С6Н12О0 —> 2С2Н5ОН + 2С02у
глюкоза этиловый
спнрг
Глюкоза в свободном виде содержится, например, в виноградном соке, при брожении которого получается виноградное вино с содержанием спирта от 8 до 16 %.
Исходным продуктом для получения спирта может служить полисахарид крахмал (стр. 478), содержащийся, например, в клубнях картофеля, зернах ржи, пшеницы, кукурузы. Для превращения в сахаристые вещества (глюкозу) крахмал предварительно подвергают гидролизу. Для этого муку или измельченный картофель заваривают горячей водой и по охлаждении добавляют солод—■ проросшие, а затем подсушенные и растертые с водой зерна ячменя. В солоде содержится диастаз (сложная смесь ферментов), действующий на процесс осахаривания крахмала каталитически. По окончании осахаривания к полученной жидкости прибавляют дрожжи, под действием фермента которых (зимазы) образуется спирт. Его отгоняют и затем очищают повторной перегонкой.
В настоящее время осахариванию подвергают также другой полисахарид — целлюлозу (клетчатку), образующую главную массу древесины, Для этого целлюлозу подвергают гидролизу в присутствии кислот (например, древесные опилки при 150—170 X обрабатывают 0,1—5% серной кислотой под давлением 0,7— 1,5 МПа). Полученный таким образом продукт также содержит глюкозу и сбраживается на спирт при помощи дрожжей (гидролизный спирт).
Наконец, зтнлозый спирт может быть получен синтетическим путем из этилена. Суммарная реакция заключается в присоединении воды к этилену (в присутствии катализаторов);
CH2=CH2 + Н20 —>■ СНз—CIV-OH
За последние годы в нашей стране построены заводы по производству синтетического этилового спирта из этилена и увеличилась выработка спирта из древесины. Это дало возможность сэкономить большое количество пищевых продуктов *,
Кроме спнртоз с одной гидроксильной группой в молекуле (одноатомные спирты, или алкоголя), известны спирты, молекулы которых содержат несколько гидроксилькых групп (многоатомные спирты).
Примерами таких спиртов могут служить двухатомный спирт этиленгликоль и трехатомный — глицерин:
СН2—СН2 снг-сн—сн2
!! II!
он он он он он
этиленгликоль глицерин
Этиленгликоль и глицерин—• высококипящне жидкости сладкого вкуса, смешивающиеся с водой во всех отношениях. Этиленгликоль применяется в качестве составной части так называемых антифризов, т. е. веществ с низкой температурой замерзания, заменяющих воду в радиаторах автомобильных и авиационных моторов в зимнее время. Водный раствор этиленгликоля (58 % -шли) замерзает только при температуре —50 °С. Этиленгликоль применяется и для изготовления синтетического волокна лавсан (см. § 177). При приеме внутрь — сильно ядовит.
Азотнокислые эфиры этиленгликоля и глицерина
сн2—сн2 СН,—сн—сн2
I I и | • | 1
0N02 0\02 0Х02 ОХ02 0N02
неправильно называемые иитроэтиленгликолгм и нитроглицерином, обладают сильными взрывчатыми свойствами и применяются для изготовления динамитов.
| * Из 5500 т сухих опилок (отходы лесопильного завода средней производительности за год) можно получить 790 т спирта (считая на 100 %-ный). Это даег возможность сэкономить около 3000 г зерна или 10 000 г картофеля, |
Фенол СвНоОН — бесцветные кристаллы (темп, плавл. 41 °С). Обладает характерным запахом и антисептическими (обеззараживающими — подавляющими развитие вредных микроорганизмов) свойствами. Как уже указывалось, кислотные свойства гидрофильного водорода выражены у фенола значительно сильнее, чем у спиртов; замещение этого водорода металлом может происходить не только при действии щелочных металлов, но и при действии щелочей. Поэтому фенол называют также карболовой кислотой.
Фенол содержится в каменноугольной смоле, а также получается синтетически из бензола. В больших количествах он идет на синтез лекарственных веществ, красителей, пластических масс (фенопластов, стр. 489), для очистки нефтяных смазочных масел.
170. Простые эфиры. Простыми эфирами называются органические соединения, молекулы которых состоят из двух углеводородных радикалов, связанных атомом кислорода. Они получаются обычно каталитическим отнятием молекулы воды от двух молекул одного или различных спиртов. Например:
С2Н8—j_0]H4-HjO—с2нв —> С2Н6-0-С2Н6 + Н20
этиловый этиловый диэтнлоаый эфир
спирт спирт
СНз—i ОН + Н;0—С2Н6 —> СН3—О—С2Н5 + Н20
метиловый этиловый метилэтнлОЕЫЙ
спирт спирт эфир
Большинство простых эфиров■—жидкости, почти нерастворимые в воде. Они довольно инертны в химическом отношении: в отличие от спиртов не имеют подвижного водорода, поэтому не реагируют с металлическим натрием; в отличие от сложных эфиров (см. § 173) не подвергаются гидролизу. Наиболее важным из простых эфиров является диэтиловый эфир (С2Н5)20 — легкопо-движиая жидкость с характерным запахом, кипящая при 35,б°С. Он широко применяется как растворитель, а в медицине — для наркоза и как составная часть некоторых лекарств.
171. Альдегиды и кетоны. В молекулах этих соединений содержится двухвалентная к а р б о н и л ь н а я г р у п п а ^с = О. В альдегидах она связана с одним атомом Н и с углеводородным радикалом *, в кетонах — с двумя углеводородными радикалами:
Н—от сн3—с
\н \н
муравьиный уксусный
альдегид альдегид
(формальдегид) (ацетальдегид)
СНзч СН,.
yz=o хс=о
СН/ СНз—сн2/
диметилкетон мстнлэтилкетон
| * В муравьином альдегиде карбонильная группа связана с двумя aiомами водорода. |
(ацетон)
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 431; Нарушение авторских прав?; Мы поможем в написании вашей работы!