
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Характеристика вагонов 81-717(714) 29 страница
|
|
|
|
В кристалле металла главной подгруппы второй группы (например, кальция) из исходных атомных s-орбиталей наружного слоя также образуется зона, состоящая из N уровней. Но, поскольку здесь каждый атом обладает двумя внешними s-электро-нами, то в этой зоне должно разместиться 2N электронов, так что все ее уровни окажутся полностью занятыми. Однако при взаимодействии атомов металла перекрываются не только внешние s-op-битали, но и внешние р-орбитали. В результате также образуется непрерывная энергетическая зона, не заполненная электронами. При этом зоны, образованные s- и р-орбиталями, перекрываются (рис. 137), так что и в этом случае зона проводимости, содержащая свободные энергетические уровни, непосредственно примыкает к валентной зоне. Таким образом, рассматриваемый кристалл также должен обладать высокой электрической проводимостью.
На рис. 136 и 137 изображена резкая граница между валентной зоной и зоной проводимости. В действительности эта граница размыта; вследствие теплового движения электроны могут переходить с верхних уровней валентной зоны на нижние уровни зоны проводимости. Способность этих электронов свободно передвигаться по кристаллу и переносить энергию из одной его части (нагретой) в другую (более холодную) служит причиной высокой теплопроводности металлов. Таким образом, и электрическая проводимость и теплопроводность металлов обусловлены возможностью свободного передвижения электронов зоны проводимости. Именно поэтому для большинства металлов наблюдается параллелизм между этими величинами. Например, лучшие проводники электричества — серебро и медь — обладают и наиболее высокой теплопроводностью (см. табл. 29).
При нагревании колебания атомов металла около их равновесных положений в кристаллической решетке становятся более интенсивными, что затрудняет движение электронов. Поэтому с повышением температуры электрическое сопротивление металлов возрастает.
Рассмотренная картина электронного строения твердых металлов показывает, что валентные электроны, осуществляющие химическую связь, принадлежат не двум или нескольким определенным атомам, а всему кристаллу металла. При этом валентные электроны способны свободно перемещаться в объеме кристалла. Образованную подобным образом химическую связь называют металлической связью, а совокупность «свободных» электронов в металле — электронным газом. Металлическая связь характерна для металлов, их сплавов и интерметаллических соединений (см. стр. 534).
Пластичность металлов также объясняется специфическими свойствами металлической связи. При механическом воздействии на твердое тело отдельные слои его кристаллической решетки сме щаются относительно друг друга. В кристаллах с атомной структурой это приводит к разрыву ковалентных связей между атомами, принадлежащими различным слоям, и кристалл разрушается. В кристаллах с ионной структурой при взаимном смещении слоев неизбежно создается такое положение, при котором рядом оказываются одноименно заряженные ионы; при этом возникают силы электростатического отталкивания и кристалл также разрушается. В случае же металла при смещении отдельных слоев его кристаллической решетки происходит лишь некоторое перераспределение электронного газа, связывающего друг с другом атомы металла, но разрыва химических связей не происходит — металл деформируется, не разрушаясь.

В отличие от металлов кристаллы простых сеществ, образованных неметаллами, обычно не обладают заметной электронной проводимостью (см. табл. 29); они представляют собою изоляторы (диэлектрики). Хотя в этом случае тоже возможно образование непрерывных энергетических зон, но здесь зона прозодимости отделена от валентной зоны запрещенной зоной, т.е. значительным энегретическим промежутком АЕ (рис. 138, изолятор). Энергия теплового движения или слабого электрического поля оказывается недостаточной для преодоления этого промежутка, и электроны не переходят из валентной зоны в зону прозодимости. Таким образом, в изоляторах электроны не могут свободно перемещаться по кристаллу и служить переносчиками электрического тока.
Особыми свойствами, отличающими их как от металлоз, так и от изоляторов, обладают полупроводники. При низких температурах их электрическое сопротивление зесьма велико и в этих условиях они проявляют свойства изоляторов. Однако при нагревании или при освещении электрическая проводимость полупроводников резко возрастает и можег достигать величии, сравнимых с проводимостью металлов.
Зависимость электрических свойств полупроводников от температуры и освещенности объясняется электронным строением их кристаллов. Здесь, как и у изоляторов, валентная зона отделена от зоны проводимости запрещенной зоной (рис. 138, полупроводник). Однако ширина запрещенной зоны АЕ в случае полупроводников невелика. Поэтому при действии квантов лучистой энергии или при нагревании электроны, занимающие верхние уровни валентной зоны, могут переходить в зону проводимости и участвовать в переносе электрического тока. С повышением температуры или при увеличении освещенности число электронов, переходящих в зону проводимости, возрастает; в соответствии с этим увеличивается и электрическая проводимость полупроводника.
При переходе электронов в зону проводимости в валентной зоне возникают не полностью занятые электронами энергетические уровни — электронные вакан*
 | |||||
 | |||||
 | |||||
а
| а — ооъемноцентрпроЗанная кубическая; о — грансцентрирс-аанная куоичеекпя; в — гексаго нальная. |
Рис. 13Э. Основные типы кристаллических pecieTc:: металлов:
а — объемноцентрпроЗанная кубическая; б
нальная.
Рис. 149. С;;ег.;а различной орке11"т£цнн кристаллических решеток в полукристаллическом
спи, пли «дырки». В электрическом поле такие дырки ведут себя как положительные электрические заряды. Поэтому перенос тока в полупроводниках может осуществляться как электронам!! зоны проводимости (я-проводныость," от латинского «negativc»— отрицательный), так и дырками валентной зоны (р-проводимость, от латинского «positive» — положительный).
191. Кристаллическое строение металлов. Кристаллическое строение металлов изучается различными методами. Их можно разделить на дзе группы. К перзой принадлежат методы изучения внутреннего строения крксталлоз, ко второй — методы изучения их знешних форм.
Внутреннее строение кристаллов изучается глазным образом с помощью рентгеноструктурного анализа (см. § 50). По его данным для всех металлов установлены типы и параметры кристаллических решеток.
Кристаллические решетки металлов могут быть различных типов. Однако для большинства металлов характерны три типа решеток: объемноцеитрировапная кубическая (Li, Na, К, V, Cr, Fe *, РЬ, \V и др.), гранецентрированная кубическая (Al, Са, Fe **, Ni, Си, Ag, Аи и др.), гексагональная (Be, Mg, Cd, Ti, Co, Zn и др.). На рис. 139 показаны элементарные ячейки (см. § 50) решеток этих тнпоз.
Размеры, форму и взаимное расположение кристаллов в металлах изучают металлографическими методами. Наиболее полную оценку структуры металла в этом отношении дает микроскопический анализ его шлифа. Из испытуемого металла вырезают образец и его плоскость шлифуют, полируют и протравливают специальным растзором (т р а в и т е л е м). В результате травления выявляется структура образца, которую рассматривают или фотографируют с помощью металлографического микроскопа.
| * При температурах до 911 и от 1392 °С до плавления, ** При температурах от 911 до 1392 °С, |
Кристаллы металлов обычно имеют небольшие размеры. Поэтому любое металлическое изделие состоит из большого числа кристаллов. Такая структура называется п о л н к р и с т а л л и ч е -с кой. При кристаллизации металла из расплавленного состояния растущие кристаллы мешают друг другу принять правильную форму. Поэтому кристаллы поликрпсталлпческого тела имеют неправильную форму и в отличие от правильно ограненных кристаллов называются кристаллитами или зернам и. Зерна различаются между собой пространственной ориентацией их кристаллических решеток (рис. 140).
При травлении шлифа границы зерен разъедаются сильнее; они становятся углубленными. Свет, падая па них, рассеивается, и в поле зрения микроскопа границы зерен представляются темными, а сами зерна — светлыми (рис. 141).
Специальными способами получают куски металлов, представляющие собой один кристалл — монокристаллы. Монокристаллы металлов, а также неметаллов изготовляют для научных исследований и для специальных отраслей техники (полупроводники, лазеры и др.).
Внутренняя структура зерна металла не является строго правильной. Металлам, как и всем реальным кристаллам (см. § 51), присущи дефекты структуры. При этом многие свойства металлов сильно зависят от характера и от числа имеющихся в металле дефектов. Так, в процессах диффузии важную роль играют вакансии. Эти процессы протекают, например, при насыщении в горячем состоянии поверхностного слоя металлического изделия другими элементами для защиты от коррозии или для придания поверхности изделия твердости. Проникновение атомов постороннего элемента в глубь металла происходит в основном по местам вакансий. С повышением температуры число вакансий возрастает, что служит одной из причин ускорения процесса диффузии.
Некоторые механические свойства металлов зависят от количества дислокаций и от их способности к перемещению по металлу. Так, высокая пластичность металлов объясняется перемещением дислокаций.

|
Схема пластического сдвига в кристалле металла изображена на рис. 142. Внешняя сила Р первоначально вызывает небольшое смещение атомов вертикальных рядов /, 2, 3 (рис. 142, а). С увеличением силы Р это смещение возрастает н ряд атомов / (выше плоскости скольжения АА) проскакивает нейтральное положение между 1' и 2'. При этом ряд 2 превращается в лишнюю плоскость и образует дислокацию (рис. 142, б), знакомую нам по рис. 62 (стр. 156). В результате образования дислокации решетка искажается по обе стороны плоскости скольжения. Поэтому далее уже при небольшой силе Р вертикальные ряды атомов над плоскостью скольжения будут смещаться — дислокация подобно эстафете будет последовательно передаваться рядам 3, 4 и далее.
Рис. 141. Микроструктура металла (стократное ^*4-«~rfЈfeS»*>.. 'J Увеличение).

В какой-то момент будет иметь место положение, представленное на рис. 142, е. В итоге же дислокация выйдет на поверхность и исчезнет, как показано на рис. 142, г.
Таким образом, пластический сдвиг в реальном металле происходит не путем одновременного сдвига всей атомной плоскости, что потребовало бы затраты гораздо большей энергии, а путем перемещения дислокаций вдоль плоскости скольжения.
Металлические кристаллы, лишенные дислокаций, обладают весьма высокой прочностью. Такими кристаллами являются выращиваемые в особых условиях нитевидные кристаллы или «усы». Их прочность во много раз превышает прочность обычных образцов соответствующего металла и близка к теоретической величине, вычисленной для кристаллической решетки металла, не имеющей дефектов структуры.
С другой стороны, появление в металле очень большого числа различно ориентированных дислокаций также приводит к повышению прочности, так как при этом кристаллическая структура металла сильно искажается н перемещение дислокаций затрудняется. В этом состоит объяснение явления наклепа — упрочнения металла под действием пластической деформации. При нагревании сильно деформированного металла искажения его структуры, вызванные сдвигами, постепенно снимаются — металл возвращается в структурно более устойчивое состояние; его пластичность возрастает, а твердость и прочность снижаются.
192. Добывание металлов из руд. Огромное большинство металлов находится в природе в виде соединений с другими элементами. Только немногие металлы встречаются в свободном состоянии, и тогда они называются самородными. Золото и платина встречаются почти исключительно в самородном виде, а серебро и медь — отчасти; иногда попадаются также самородные ртуть и некоторые другие металлы.
Добывание золота и платины производится или посредством механического отделения их от той породы, в которой они заключены, например промывкой водой, или путем извлечения их из породы различными реагентами с последующим выделением из раствора. Все же остальные металлы добываются химической переработкой их природных соединений.
Минералы и горные породы, содержащие соединения металлов и пригодные для получения этих металлов заводским путем, носят название руд- Главнейшие руды содержат оксиды, сульфиды п карбонаты металлов. Получение металлов из руд составляет задачу металлургии — одной из наиболее древних отраслей химической промышленности. Металлургические процессы, протекающие при высоких температурах, называются пирометал-л у р г и ч е с к и м и. Пирометаллургпческнм путем получают, например, чугун и сталь.
Важнейший способ получения металлов из руд основан на восстановлении их оксидов углем или СО. Если, например, смешать красную медную руду Cu20 с углем и накалить, то уголь, восстанавливая медь, превращается в оксид углерода (II), а медь выделяется в расплавленном состоянии:
Cu20 + С = 2Cu + COf
Выплавка чугуна производится восстановлением железных руд оксидом углерода.
При переработке сульфидных руд сперва переводят сульфиды в оксиды путем обжига в специальных печах, а затем уже восстанавливают полученные оксиды углем. Например: 2ZnS + 302 = 2ZnO -f 2S02t ZnO + С = Zn + COt
Кроме пирометаллургических методов, при добывании металлов применяются гидрометаллургические методы. Они представляют собою извлечение металлов из руд в виде их соединений водными растворами различных реагентов с последующим выделением металла из раствора. Гидрометаллургическим путем получают, например, золото (см. § 202).
Обычно руды представляют собой совокупность минералов. Минералы, содержащие извлекаемый металл, называются рудными минералами, все остальные — пустой породой. Последняя чаще всего состоит из песка, глины, известняка, которые трудно плавятся. Чтобы облегчить выплавку металла, к руде примешивают специальные вещества — флюсы. Флюсы образуют с веществами пустой породы легкоплавкие соединения — шлаки, которые обычно собираются на поверхности расплавленного металла и удаляются. Если пустая порода состоит из известняка, то в качестве флюса применяется песок. Для руд, содержащих большие количества песка, флюсом служит известняк. В обоих случаях в качестве шлака образуется силикат кальция, поскольку песок состоит в основном из диоксида кремния.
Во многих рудах количество пустой породы столь велико, что непосредственная выплавка металла из таких руд экономически невыгодна. Такие руды предварительно обогащают — отделяют от них часть пустой породы. В остающемся концентрате содержание рудного минерала повышается. Существуют различные способы обогащения руд. Чаще других применяются флотационный, гравитационный и магнитный способы.
Флотационный метод основан на различной смачиваемости поверхности минералов водою. Тонкоизмельченную руду обрабатывают водой, к которой добавлено небольшое количество флотационного реагента, усиливающего различие в смачиваемости частиц рудного минерала и пустой породы. Через образующуюся смесь энергично продувают воздух; при этом его пузырьки прилипают к зернам тех минералов, которые хуже смачиваются. Эти минералы выносятся вместе с пузырьками воздуха на поверхность и таким образом отделяются от пустой породы.
Гравитационное обогащение основано на различии плотности и вследствие этого скорости падения зерен минералов в жидкости.
Магнитный способ основан на разделении минералов по их магнитным свойствам.
Не все металлы можно получить восстановлением их оксидов углем или СО. Подсчитаем, например, стандартную энергию Гиббса реакции восстановления хрома:
Сг203 + ЗСО = 2Сг + ЗС02
о
Воспользовавшись табл. 7 (стр. 194), находим AG06p сг2о3 — = —1059 кДж/моль, AG05pco2 = —394,4 кДж/моль, AGo6p со =3 = -137,1 кДж/моль, откуда AG° = 3 (-394,4) - [-1059 + + 3(—137,1)] = +267,1 кДж. Полученная величина положительна. Это показывает, что при 25 °С и стандартных концентрациях реагирующих веществ реакция не протекает в интересующем нас направлении. Положительное и большое по абсолютной величине значение AG° указывает на то, что реакция не протекает в направлении восстановления металла не только при стандартных условиях, но и при температурах и концентрациях, заметно отличающихся от стандартных.
Для металлов, не восстанавливаемых ни углем, ни оксидом углерода (II), применяются более сильные восстановители: водород, магний, алюминий, кремний. Восстановление металла из его оксида с помощью другого металла называется металлотермией. Если, в частности, в качестве восстановителя применяется алюминий, то процесс носит название алюминотермии. Такие металлы, как хром, марганец, получают главным образом алюминотермией, а также восстановлением кремнием. Если мы подсчитаем AG° реакции
Сг203 + 2А1 = 2Сг + А1203
то получим отрицательную величину (—523 кДж). Это говорит о том, что восстановление хрома алюминием может протекать самопроизвольно.
Наконец, металлы, оксиды которых наиболее прочны (алюминий, магний и другие), получают электролизом (см. § 103).
193. Получение металлов высокой чистоты. На протяжении последних десятилетий в связи с развитей новых отраслей техники потребовались металлы, обладающие очень высокой чистотой. Например, для надежной работы ядерного реактора необходимо, чтобы в расщепляющихся материалах такие «опасные» примеси, как бор, кадмий и другие, содержались в количествах, не превышающих миллионных долей процента. Чистый цирконий — один из лучших конструкционных материалов для атомных реакторов — становится совершенно непригодным для этой цели, если в нем содержится даже незначительная примесь гафния. В используемом в качестве полупроводника германии допускается содержание не более одного атома фосфора, мышьяка или сурьмы на десять миллионов атомов металла. В жаропрочных сплавах, широко применяемых, например, в ракетостроении, совершенно недопустима даже ничтожная примесь свинца или серы.
В связи с потребностями промышленности разработаны новые методы очистки веществ. Рассмотрим наиболее важные из них.
Перегонка в вакууме. Этот метод основан на различии летучестей очищаемого металла и имеющихся в нем примесей. Исходный металл загружается в специальный сосуд, соединенный с вакуум-насосом, после чего нижняя часть сосуда нагревается. В ходе перегонки на холодных частях сосуда осаждаются либо примеси* (если они более летучи, чем основной металл), либо очищенный металл (если примеси менее летучи). Процесс ведется при непрерывной откачке воздуха, так как присутствие даже небольших количеств кислорода приводило бы к окислению поверхности расплавленного металла и тем самым к торможению процесса испарения.
Зонная плавка заключается в медленном протягивании бруска очищаемого металла через кольцевую печь. Тот участок (зона) бруска, который находится в данный момент в печи, плавится. По мере продвижения бруска жидкая зона перемещается от начала бруска к его концу.
| * Точнее говоря, в этом случае осаждается основной металл, сильно обога-. щенпый примесями. |
Зонной плавке подвергают металл, прошедший предварительную очистку. Содержание примесей в нем уже невелико, так что основной металл и примеси образуют гомогенный твердый раствор. При движении бруска через кольцевую печь происходит плавление металла у"передней границы зоны и кристаллизация его у задней границы. При этом состав образующихся кристаллов, находящихся в равновесии с расплавом, отличается от состава расплава (см. стр. 530). Примеси одних металлов концентрируются в расплавленной зоне и перемещаются вместе с ней к концу бру-
ска; примеси других металлов концентрируются в образующихся кристаллах, остаются за движущейся зоной и при неоднократном повторении процесса перемещаются к началу бруска. В результате средняя часть бруска получается наиболее чистой; ее вырезают и используют.
Зонную плазку применяют для очистки не только металлов, но и других веществ.
Термическое разложение летучих соединений металла. Карбонильный процесс. Этот метод применяется для получения высокочистых никеля и железа. Подлежащий очистке никель нагревают в атмосфере оксида углерода (II), находящегося под давлением около 20МПа. При этом никель взаимодействует с СО, образуя летучий тетракарбонил никеля Ni(CO)4 (теми. кип. 42 °С); содержащиеся в исходном металле примеси в такого рода реакцию не вступают. Образовавшийся Ni(CO)4 отгоняют, а затем нагревают до более высокой температуры. В результате карбонил разрушается с выделением высокочистого металла.
При очистке железа аналогичным образом осуществляется jipo-цесс синтеза и последующего разложения пентакарбонила железа Fe(CO)5 (темп. кип. 105 DC).
Иодидный способ дает возможность получать титан, цирконий и некоторые другие металлы значительной чистоты. Рассмотрим этот процесс на примере титана. Исходный металл в виде порошка нагревается до 100—200 °С с небольшим количеством иода в герметическом аппарате. В аппарате натянуты титановые нити, нагреваемые электрическим током до 1300—1500 °С. Титан (но не примеси) образует с иодом летучий ноднд TiU, который разлагается на раскаленных нитях. Выделяющийся чистый титан осаждается на них, а иод образует с исходным металлом нозые порции иодида; процесс идет непрерывно до переноса всего металла па титановые нити.
Процесс можно представить схемой:
ТЦзагрязнеиный) +
100-200 °С 1300-1500 °с
+ 212(газ) --------------- *■ ТП4 (газ) ■---------- >■ ТКчистый) + 212(газ)
-t________________________________________________________ I
194. Сплавы. Для изготовления оборудования в различных отраслях современной промышленности используются самые разнообразные материалы, как природные, так и созданные руками человека. Однако основа современной техники — машины и механизмы — изготовляются в основном из металлических материалов — металлов, сплавов металлов друг с другом и с некоторыми неметаллами, прежде всего с углеродом. Это связано с тем, что из всех видов материалов металлические материалы обладают наиболее ценными механическими свойствами. Кроме 
того, металлические, материалы очень многочисленны и разнообразны по своим свойствам.
В жидком состоянии большинство металлов растворяются друг в друге и образуют однородный жидкий сплав. При кристаллизации из расплавленного состояния различные металлы ведут себя по-разному. Основными случаями являются при этом следующие три.
1. В твердом состоянии сплавляемые металлы не растворяются и химически не взаимодействуют друг с другом. При этих условиях сплав представляет собою механическую смесь и состоит из кристаллитов одного и другого компонентов *, отчетливо выявляемых на микрошлкфе (рис. 143).
2. Сплавляемые металлы взаимодействуют друг с другом, образуя химическое соединение.
3. При кристаллизации из расплава растворимость металлов друг в друге сохраняется. Образуются однородные кристаллы, В этом случае твердая фаза носит название твердого раствора (рис. 144). При этом для одних металлов их взаимная растворимость в твердом состоянии неограниченна, другие же растворимы друг в друге лишь до определенных концентраций.
195. Диаграммы состояния металлических систем. При изучении свойств сплавов очень большое значение имеют диаграмм ы состояния, характеризующие состояние сплавов различного состава при разных температурах. Такие диаграммы показывают термодинамически устойчивые состояния, т. е. состояния, отвечающие минимуму энергии Гиббса системы. Их называют также фазовыми диаграммами, так как они показывают, какие фазы могут сосуществовать при данных условиях.
| * По-видимому, нет металлов, абсолютно нерастворимых друг в друге в твердом состоянии. Но в тех случаях, когда взаимная растворимость металлов не превышает сотых долей процента, принято считать, что они нерастворимы друг в друге, |
Диаграммы состояния получают экспериментально. Обычно для этого строят кривые охлаждения и по остановкам и переги-
бам на них, вызванным теплозымн эффектами превращений, определяют температуры этих превращений. Для получения кривых охлаждения приготовляют из двух металлов изучаемой системы ряд смесей различного состава. Каждую из приготовленных смесей расплавляют. Получающиеся жидкие сплазы (расплавы) медленно охлаждают, отмечая через определенные промежутки вре^ мени температуру остывающего сплава. По данным наблюдений строят кривые охлаждения, откладывая на оси абсцисс зремя, а на оси ординат — температуру (рис. 145).
На рис. 145 слева показано, какой вид имеет кривая охлаждения чистого расплавленного металла. Сначала понижение температуры плавно идет по кривой ak. В точке k происходит передо;,! кривой, начинается образование твердой фазы (кристаллизация), сопровождающееся выделением теплоты, вследствие чего температура некоторое время остается постоянной (кривая идет параллельно оси абсцисс). Когда вся масса расплавленного металла затзердеет, опять начинается плавное понижение температуры по кривой св.
Иногда остановки в падении температуры наблюдаются и на кривой охлаждения твердого металла, указывая на связанные с выделением теплоты процессы, происходящие уже в твердом веществе, например переход из одной кристаллической формы в другую.
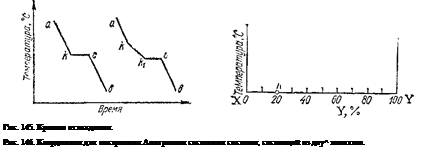
Несколько иной вид имеет кривая охлаждения сплава двух металлов. Такая кривая изображена на рис. 145 справа. Точка к, как и на перзой кривой, отвечает началу затвердевания—началу выделения из сплава кристаллов одного из входящих в него металлов. При этом состав остающегося жидким сплаза изменяется, и температура его затзердевапия непрерывно понижается во время кристаллизации. Однако выделяющаяся при кристаллизации теплота все же замедляет ход охлаждения, вследствие чего в точке к происходит перелом кривой. Выпадение кристаллов и плавное понижение температуры присходят до тех пор, пока не достигается температура, при которой сплаз закристаллизовывается без изменения состава. Здесь падение температуры приостанавливается
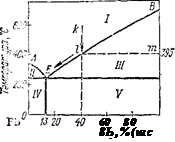 Рис. М7. Диаграмма состояния сиси&;ы Vb — sb.
Рис. М7. Диаграмма состояния сиси&;ы Vb — sb.
(точка ki). Когда кристаллизация закончится, температура падает по кривой св.
Имея достаточный набор сплавов, различающихся содержанием компонентов и определив в каждом сплаве температуры превращений, можно построить диаграмму состояния. На диаграммах состояния по вертикальной оси откладывают температуру, а по горизонтальной — состав сплава (содержание одного из компонентов). Для сплавов, состоящих из двух компонентов, обозначаемых буквами X и Y, состав характеризуется на отрезке прямой, принятом за 100 %. Крайние точки соответствуют индивидуальным компонентам. Любая же точка отрезка, кроме крайних, характеризует состав двойного сплава. На рис. 146 числа указывают содержание компонента 3'. Например, точка К отвечает сплаву, состоящему нз 20 % У и 80 % X.
Рассмотрим четыре простых случая — четыре типа диаграмм, соответствующие упомянутым выше типам сплавов: механической смеси, твердому раствору с неограниченной и с ограниченной растворимостью и химическому соединению.
Диаграмма состояния для сплавов, образующих механические смеси индивидуальных компонентов. В качестве примера диаграммы этого типа на рис. 147 приведена диаграмма состояния системы Pb—Sb. Точки Л и В иа диаграмме—это температуры плавления компонентов системы: свинца (327°С) и сурьмы (631°С). В сплавах рассматриваемого типа добавка одного компонента к другому, согласно закону Рауля, понижает температуру начала его кристаллизации (затвердевания). Кривая АЕ показывает температуру кристаллизации свинца из расплавов, богатых свинцом, а кривая BE — температуру кристаллизации сурьмы из расплавов, богатых сурьмой. Видно, что по мере увеличения содержания второго компонента температуры кристаллизации как свинца, так и сурьмы понижаются. Точка Е принадлежит обеим кривым: из расплава, состав которого отвечает этой точке, кристаллизуются одновременно еба металла. Эта совместная кристаллизация происходит при самой низкой температуре. Отвечающий точке Е состав называется эвтектическим составом, а соответствующий сплав — эвтектическим сплавом или просто эвтектикой (от греческого «эвтектикос» — хорошо плавящийся). Для системы Pb—Sb эвтектика состоит из 13 % Sb и 87 % Pb; она плавится и кристаллизуется при 246 °С.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 406; Нарушение авторских прав?; Мы поможем в написании вашей работы!