
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Характеристика вагонов 81-717(714) 31 страница
|
|
|
|
Контактная коррозия может протекать, когда два металла с различными потенциалами соприкасаются друг с другом либо в водной среде, либо при наличии влаги, конденсирующейся из воздуха. Так же, как и в рассмотренном выше случае значительных включений, металлы оказывают друг на друга поляризующее действие; металл с меньшим потенциалом поляризуется анод-но, и скорость его коррозии вблизи места контакта резко возрастает.
Контактная коррозия наблюдается, например, в теплофикационных установках, когда медные нагревательные змеевики соединены с железными кипятильниками или трубами. Интенсивная коррозия железа протекает около мест соединения. Однако соотношение между потенциалами контактирующих металлов зависит не только от природы металлов, но также от природы растворенных в воде веществ, от температуры и от других условий и не всегда соответствует взаимному положению металлов в ряду напряжений. Так, в случае контакта железо — цинк последний интенсивно корродирует при комнатной температуре, но в горячей воде полярность металлов изменяется и растворяться начинает железо.
Для предупреждения коррозии и защиты от нее применяются разнообразные методы. К важнейшим из них относятся следующие:
1) применение химически стойких сплавов;
2) защита поверхности металла покрытиями;
3) обработка коррозионной среды;
4) электрохимические методы.
Из химически стойких сплавов наиболее широкое применение имеют нержавеющие стали, в состав которых входит до 18 % хрома и до 10 % никеля.
Покрытия, применяемые для защиты металлов, подразделяются на металлические, неметаллические и образованные в результате химической или электрохимической обработки поверхности металла.'
В качестве металлов для покрытия обычно применяют металлы, образующие на своей поверхности защитные пленки. Как уже говорилось, к таким металлам относятся хром, никель, цинк, кадмий, алюминий, олово и некоторые другие. Значительно реже применяются металлы, имеющие высохни электродный потенциал— серебро, золото. Существуют различные способы нанесения металлических покрытий; наибольшие преимущества имеют методы гальванотехники (см. § 103).
К неметаллическим относятся покрытия лаками, красками, эмалями, феиолоформальдегиднымп и другими смолами. Для длительной защиты от атмосферной коррозии металлических сооружений, деталей, машин, приборов чаще всего применяются лакокрасочные покрытия.
Покрытия, создаваемые химической или электрохимической обработкой металла, представляют собой в основном защитные оксидные или солевые пленки. Примерами могут служить оксидирование алюминия (создание на его поверхности стойких оксидных пленок), фосфатирование стальных изделий (создание защитных пленок, состоящих из фосфатов).
Метод обработки внешней среды пригоден для случаез, когда защищаемое изделие эксплуатируется в ограниченном объеме жидкости. Метод состоит в удалении из раствора, в котором эксплуатируется защищаемая деталь, растворенного кислорода (деаэрация) или в добавлении к этому раствору веществ, замедляющих коррозию, — ингибиторов. В зависимости от природы металла и раствора применяются различные ингибиторы: нитрит натрия, хромат и дихромат калия, фосфаты натрия, некоторые высокомолекулярные органические соединения и другие. Защитное действие этих веществ обусловлено тем, что их молекулы или ионы адсорбируются на поверхности металла н каталитически снижают скорость коррозии, а некоторые из них (например, хроматы и дихроматы) переводят металл в пассивное состояние.
К электрохимическим методам защиты металлов относятся катодная защита и метод протекторов. При катодной защите защищаемая конструкция или деталь присоединяется к отрицательному полюсу источника электрической энергии и становится катодом. В качестве анодов используются куски железа. При надлежащей силе тока в цепи на защищаемом изделии происходит восстановление окислителя, процесс же окисления претерпевает вещество анода.
Метод протекторов осуществляется присоединением к защищаемому металлу большого листа, изготовленного из другого, более активного металла—-протектора. В качестве протектора при защите стальных изделий обычно применяют цинк или сплавы на основе магния. При хорошем контакте между металлами защищаемый металл (железо) и металл протектора (например, цинк) оказывают друг на друга поляризующее действие. Согласно взаимному положению этих металлов в ряду напряжений, железо поляризуется катодно, а цинк — анодно. В результате этого на железе идет процесс восстановления того окслителя, который присутствует в воде (обычно растворенный кислород), а цинк окисляется.
И протекторы, и катодная защита применимы в средах, хорошо проводящих электрический ток, например в морской воде. В частности, протекторы широко применяются для защиты подводных частей морских судов. Ясно, что убытки, вызванные коррозией корпуса морского судна и связанные с его простоем и ремонтом, очень велики и во много раз превышают стоимость протекторов,
Глава ПЕРВАЯ ГРУППА
XVII ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
ЩЕЛОЧНЫЕ МЕТАЛЛЫ
Металлы главной подгруппы первой группы — литий, натрий, калий, рубидий, цезий и франций — называются щелочными металлами. Это название связано с тем, что гидроксиды двух главных представителей этой группы — натрия и калия — издавна были известны под названием щелочей. Из этих щелочен, подвергая их в расплавленном состоянии электролизу, Г. Дэви в 1807 г. впервые получил свободные калий и натрий.

Во внешнем электрнном слое атомы щелочных металлов имеют по одному электрону. Во втором снаружи электронном слое
у атома лития содержатся два электрона, а у атомов остальных щелочных металлов — по восемь электронов. Имея во внешнем электронном слое только по одному электрону, находящемуся на сравнительно большом удалении от ядра, атомы этих элементов довольно легко отдают этот электрон, т. е. характеризуются низкой энергией ионизации (табл. 30). Образующиеся при этом однозарядные положительные ионы имеют устойчивую электронную структуру соответствующего благородного газа (ион лития — структуру атома гелия, ион натрия — атома неона и т. д.). Легкость отдачи внешних электронов характеризует рассматриваемые элементы как наиболее типичные представители металлов: металлические свойства выражены у щелочных металлов особенно резко.
Одинаковое строение не только наружного, но и предпоследнего электронного слоя атомов всех щелочных металлов, кроме лития, обусловливает большое сходство свойств этих элементов. В то же время увеличение заряда ядра и общего числа электронов в атоме при переходе сверху вниз по подгруппе создает некоторые различия в их свойствах. Как и в других группах, эти различия проявляются главным образом в увеличении легкости отдачи валентных электронов и усилении металлических свойств с возрастанием порядкового номера.
197. Щелочные металлы в природе. Получение и свойства щелочных металлов. Вследствие очень легкой окисляемости щелочные металлы встречаются в природе исключительно в виде соединений. Натрий и калий принадлежат к распространенным элементам: содержание каждого из них в земной коре равно приблизительно 2 % (масс). Оба металла входят в состав различных минералов и горных пород силикатного типа. Хлорид натрия содержится в морской воде, а также образует мощные отложения каменной соли во многих местах земного шара. В верхних слоях этих отложений иногда содержатся довольно значительные количества калия, преимущественно в виде хлорида или двойных солей с натрием и магнием. Однако большие скопления солей калия, имеющие промышленное значение, встречаются редко. Наиболее важными из них являются Соликамские месторождения в СССР, страссфуртские в ГДР и эльзасские — во Франции. Залежи натриевой селитры находятся в Чили. В воде многих озер содержится сода. Наконец, огромные количества сульфата натрия находятся в заливе Кара-Богас-Гол Каспийского моря, где эта соль в зимние месяцы толстым слоем осаждается на дне.
Значительно меньше, чем натрий и калий, распространены литий, рубидий и цезий. Чаще других встречается литий, но содержащие его минералы редко образуют большие скопления. Рубидий и цезий содержатся в небольших количествах в некоторых литиевых минералах.
Все известные изотопы франция радиоактивны и быстро распадаются. Первым был открыт изотоп 223Fr; его существование было установлено французской исследовательницей М. Пере в 1939 г. Он образуется прн распаде актиния и в ничтожном количестве встречается в природе. В настоящее время небольшие количества франция получают искусственно.
Натрий и литий получают электролизом расплавов их соединений, калий — восстановлением из расплавов КОН или КС! натрием, рубидий и цезий — восстановлением из их хлоридов кальцием.
Все щелочные металлы кристаллизуются в кубической объем-ноцентрнрованной решетке. Они обладают металлическим блеском, который можно наблюдать иа свежем разрезе металла. На воздухе блестящая поверхность металла сейчас же тускнеет вследствие окисления.
Щелочные металлы характеризуются незначительной твердостью, малой плотностью и низкими температурами плавления и кипения. Наименьшую плотность имеет литий, самую низкую температуру плавления — франций (см.табл. 30).
Приведенные в табл. 30 данные показывают, что в большинстве случаев свойства щелочных металлов закономерно изменяются при переходе от лития к цезию. В основе наблюдающихся закономерностей лежит возрастание массы и радиуса атома в подгруппе сверху вниз. Рост массы приводит к возрастанию плотности. Увеличение радиуса обусловливает ослабление сил притяжения между атомами, что объясняет снижение температур плавления и кипения н уменьшение энергии атомизации металлов, а также уменьшение энергии ионизации атомов при переходе от лития к цезию. Однако стандартные электродные потенциалы щелочных металлов изменяются в ряду Li — Cs не так правильно. Причина этого, подробно рассмотренная в § 100, заключается в том, что величины электродных потенциалов связаны с несколькими факторами, различно изменяющимися при переходе от одного элемента подгруппы к другому.
Щелочные металлы принадлежат к числу наиболее активных в химическом отношении элементов. Их высокая химическая активность обусловлена в первую очередь низкими значениями энергии ионизации их атомов — легкостью отдачи ими валентных электронов. При этом энергия ионизации уменьшается при переходе от лития к цезию (табл. 30). Ясно, что химическая активность при этом возрастает.
Все щелочные металлы энергично соединяются с кислородом. Рубидий и цезий самовоспламеняются на воздухе; литий, натрий и калий загораются при небольшом нагревании. Характерно, что только литий, сгорая, образует нормальный оксид Li20, остальные же щелочные металлы превращаются в пероксидные соединения: Na202, К02, RbOa, Cs02.
Не менее энергично, чем с кислородом, взаимодействуют щелочные металлы с галогенами, особенно с хлором и фтором,
В ряду напряжений щелочные металлы стоят далеко впереди водорода и вытесняют водород из воды; при этом образуются сильные основания, например:
2К + 2НОН = 2КОН + Н2 г
Легко отдавая при химических реакциях свои валентные электроны, щелочные металлы являются самыми энергичными восстановителями. Их восстановительная способность настолько велика, что они могут восстанавливать даже атомы водорода, превращая их в отрицательно заряженные ионы Н_. Так, при нагревании щелочных металлов в струе водорода получаются их гидриды, например:
2Na + Н2 = 2NaH
Гидриды щелочных металлов имеют ионное строение. Металл входит в их состав в виде катиона, а водород— в виде аниона.
Большинство солей щелочных металлов хорошо растворимы в воде. Мало растворимы LiF. Li2C03, Li3P04, Na[Sb(OH)6], КСЮ4, K2[PtCl6], Rb[PtCl6], RbCi04 и CsC104.
Если внести в пламя газовой горелки соль щелочного металла, то она разлагается, и пары освободившегося металла окрашивают пламя в характерный для данного металла цвет. Литий окрашивает пламя в карминово-красный цвет, натрий — в желтый, калий — в фиолетовый. Таким путем можно обнаружить эти элементы в соответствующей пробе.
Щелочные металлы и их соединения широко используются в технике. Литий применяется в ядерной энергетике. В частности, изотоп 6Li служит промышленным источником для производства трития, а изотоп 7Li используется как теплоноситель в урановых реакторах. Благодаря способности лития легко соединяться с водородом, азотом, кислородом, серой, он применяется в металлургии для удаления следов этих элементов из металлов и сплавов. LiF и LiC! входят в состав флюсов, используемых при плавке металлов и сварке магния и алюминия. Используется литий и его соединения и в качестве топлива для ракет. Смазки, содержащие соединения лития, сохраняют свои свойства при температурах от —60 до -4-150 °С. Гидроксид лития входит в состав электролита щелочных аккумуляторов (см. § 244), благодаря чему в 2—3 раза возрастает срок их службы. Применяется литий также в керамической, стекольной и других отраслях химической промышленности. Вообще, по значимости в современной технике этот металл является одним из важнейших редких элементов.
Цезий и рубидий применяются для изготовления фотоэлементов. В этих приборах, преобразующих лучистую энергию в энергию электрического тока и основанных на явлении фотоэлектрического эффекта (см. § 23), используется способность атомов цезия
198. Натрий
S47
и рубидия отщеплять валентные электроды при действии на металл лучистой энергии.
Однако наибольшее практическое значение имеют натрий, калий и их соединения.
198. Натрий (Natrium). Металлический натрий получают электролизом расплава хлорида натрия, к которому для снижения температуры плавления добавляют хлорид кальция.
В расплавленном состоянии хлориды натрия и кальция смешиваются неограниченно, а в твердом — нерастворимы друг в друге. В соответствии с этим системе NaCl — СаС12 отвечает простая диаграмма состояния с эвтектикой, подобная изображенной на рис. 147 (стр. 528). Эвтектическая смесь хлоридов натрия и кальция плавится при 505 °С, что почти на 300 °С ниже, чем температура плавления NaCl.
Натрий представляет собой серебристо-белый металл. Он настолько мягок, что легко режется ножом. Вследствие легкой окисляемое™ на воздухе натрий хранят под слоем керосина.
Важнейшие области применения натрия — это атомная энергетика, металлургия, промышленность органического синтеза. В атомной энергетике натрий и его сплав с калием применяются в качестве жидкометаллических теплоносителей. Сплав натрия с калием, содержащий 77,2 % (масс.) калия, находится в жидком состоянии в широком интервале температур (темп, плавл. —12,8 °С), имеет высокий коэффициент теплопередачи и не взаимодействует с большинством конструкционных материалов ни при обычных, ни при повышенных температурах. В металлургии нат-рийтермическим методом получают ряд тугоплавких металлов, а восстанавливая натрием КОН выделяют калий. Кроме того, натрий используется как добавка, упрочняющая свинцовые сплавы. В промышленности органического синтеза натрий используется при получении многих веществ. Он служит также катализатором при получении некоторых органических полимеров.
Со ртутью натрий образует твердый сплав — амальгаму натрия, которая иногда используется как более мягкий восстановитель вместо чистого металла.
Важнейшие соединения натрия с кислородом — это оксид натрия Na20 и пероксид натрия Na202.
Оксид натрия Na20 может быть получен путем пропускания над натрием, нагретым не выше 180°С, умеренного количества кислорода или нагреванием пероксида натрия с металлическим натрием:
Na202 + 2Na = 2Na20
Оксид натрия бурно реагирует с водой с образованием гидроксида натрия и выделением большого количества теплоты!
Na20 + Н20 = 2NaOH
Пероксид натрия Na202 образуется при сжигании натрия на воздухе или в кислороде. В заводских условиях пероксид натрия готовят нагреванием расплавленного натрия в токе воздуха, освобожденного от С02. Получающийся продукт имеет слабо-желтоватую окраску, обусловленную примесью соединения Na02, называемого надперекисью, или супероксидом, натрия.
Пероксид натрия —очень сильный окислитель. Многие органические вещества при соприкосновении с ним воспламеняются.
При осторожном растворении пероксида натрия в холодной воде получается раствор, содержащий гидроксид натрия и пероксид водорода. Взаимодействие пероксида натрия с водой представляет собой гидролиз соли, образованной слабой кислотой — пероксидом водорода — и сильным основанием — NaOH:
Na202 + 2H20 =f=± H202 + 2NaOH
или
02" + 2H20 ц=£ Н202 + 20Н"
Если нагревать полученный раствор, то вследствие разложения пероксида водорода из него выделяется кислород.
При действии на пероксид натрия разбавленных кислот также получается пероксид водорода, например:
Na202 + H2S04 = Н202 + Na2S04
или
0\- + 2Н+ = Н202
Пероксид натрия применяется для отбелки тканей, шерсти, шелка и т. п. Важное значение имеет реакция взаимодействия пероксида натрия с диоксидом углерода:
2Na202 + 2С02 = 2Na2C03 + 03
На этой реакции основано применение пероксида натрия для регенерации воздуха в изолированных помещениях.
Гидроксид натрия NaOH образует твердые белые, очень гигроскопичные кристаллы, плавящиеся при 322 °С. Ввиду сильного разъедающего действия на ткани, кожу, бумагу и другие органические вещества он называется также едким натром («натр» — старое название оксида натрия). В технике гидроксид натрия часто называют каустической содой.
В воде гидроксид натрия растворяется с выделением большого количества теплоты вследствие образования различных гидратов.
Гидроксид натрия следует хранить в хорошо закупоренных сосудах, так как он легко поглощает из воздуха диоксид углерода, постепенно превращаясь в карбонат натрия.
Основным способом получения гидроксида натрия является электролиз водного раствора хлорида натрия. В ходе электролиза на катоде разряжаются ионы водорода и одновременно вблизи
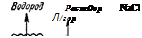 |
Рис. 154. Схема электролизера с вертикальной диафрагмой:
/—диафрагма; 2 — катод; 3 — анодное пространство; 4 — катодное пространство; 5 — аноды.
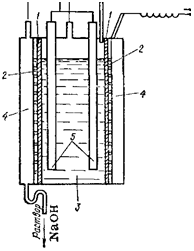
катода накапливаются ионы натрия и гидроксид-иоиы, т. е. получается гидроксид натрия; на аноде выделяется хлор. Очень важно, чтобы продукты электролиза не смешивались, так как гидроксид натрия легко взаимодействует с хлором; в результате образуются хлорид и гипохлорит натрия:
2NaOH + С12 = NaCl + NaOCl + Н20
Для того чтобы воспрепятствовать проникновению хлора в раствор гидроксида натрия, чаще всего применяют диафрагме н н ы й способ, при котором анодное и катодное пространства отделены друг от друга перегородкой (диафрагмой) из асбеста или другого пористого материала. В электролизерах, служащих для получения гидроксида натрия по этому способу (рис. 154), вертикально установленная диафрагма /, плотно прилегающая к стальному дырчатому катоду 2, отделяет анодное пространство 3 от катодного 4 и препятствует смешиванию продуктов электролиза. Анодами служат графитовые стержни 5. В процессе электролиза в анодное пространство непрерывно поступает раствор хлорида натрия, а из катодного вытекает раствор, содержащий смесь хлорида и гидоксида натрия. При его выпаривании выкристаллизовывается хлорид натрия и остается почтя чистый раствор щелочи. Последний отделяют от хлорида натрия и выпаривают до полного удаления воды. Полученный NaOH сплавляют и отливают в формы. Побочными продуктами при получении гидроксида натрия являются хлор и водород.
Несколько иначе протекает электролиз раствора хлорида натрия, если катодом служит металлическая ртуть. Перенапряжение выделения водорода на ртути очень велико. Поэтому здесь у катода разряжаются не ионы водорода, а ионы натрия. Выделяющийся натрий растворяется в ртути, образуя амальгаму натрия. Амальгаму разлагают горячей водой, причем получается гидроксид натрия, выделяется водород и освобождается ртуть. Таким образом, пользуясь в качестве катода ртутью, можно получать чистый гидроксид натрия, не содержащий в виде примеси хлорид натрня.
Кроме электролитического способа получения гидроксида натрия, иногда еще применяют более старый способ — кипячение раствора соды с гашеной известью:
Na2C03 + Са(ОН)2 = СаС03| + 2NaOH
По окончании реакции раствор сливают с осадка карбоната кальция и, выпарив воду, сплавляют полученный гидроксид натрия.
Гидроксид натрия — один из важнейших продуктов основной химической промышленности, В больших количествах он потребляется для очистки продуктов переработки нефти; гидроксид натрия широко применяется в мыловаренной, бумажной, текстильной и других отраслях промышленности, а также при производстве искусственного волокна.
Только в СССР в 1985 г. было произведено 3,1 млн. т NaOH Натрий образует соли со всеми известными кислотами. Важнейшие из них были описаны при рассмотрении свойств соответствующих кислот. Многие соли натрия образуют кристаллогидраты с довольно большим содержанием кристаллизационной воды (например, Na2S203-5H20, Na2CQ3- 10Н2О, Na2S04-10Н2О).
В организме человека натрий в виде его растворимых солен, главным образом хлорида, фосфата и бикарбоната, содержится в основном во внеклеточных жидкостях — плазме крови, лимфе, пищеварительных соках. Осмотическое давление плазмы крови поддерживается на необходимом уровне прежде всего за счет хлорида натрия.
199. Калий (Kalium). По внешнему виду, а также по физическим н химическим свойствам калий очень похож на натрий, но обладает еще большей активностью. Подобно натрию он имеет серебристо-белый цвет, быстро окисляется на воздухе и бурно реагирует с водой с выделением водорода.
Гидроксид калия, или едкое кали, КОН получается аналогично гидроксиду натрия — электрелизом раствора хлорида калия. Хотя действие его такое же, как и гидроксида натрия, но применяется он гораздо реже, ввиду его более высокой стоимости.
Соли калия очень сходны с солями натрия, но обычно выделяются из растворов без кристаллизационной воды.
Калий принадлежит к числу элементов, необходимых в значительном количестве для питания растений. Хотя в почве находится довольно много солей калия, но и уносится его с некоторыми культурными растениями также очень много. Особенно много калия уносят лен, конопля и табак.
Калий отлагается в растениях главным образом в стеблях, поэтому удобрение земли навозом, содержащим солому, отчасти пополняет убыль калия. Но так как стебли перечисленных выше растений используются для промышленных целей, то в конце концов большая часть калия уходит из почвы, и для пополнения его убыли необходимо вносить в почву калийные удобрения.
Источником получения калийных удобрений служат естественные отложения калийных солей. В СССР такие отложения находятся в районе Соликамска. Пласты соли, состоящие главным образом из минералов карналлита KCl-MgCl2-6H20 и сильвинита KCl-NaCl, залегают на большой площади между верховьями Камы и предгорьями Урала. В пределах СССР калийные месторождения имеются также в Саратовской области и в Западной Украине. По запасам калийных солей наша страна занимает первое место в мире.
В качестве калийных удобрений применяют как природные вещества, так и продукты их переработки. Из природных веществ используется главным образом сильвинит. Продуктами переработки, находящими наибольшее применение, являются хлорид и сульфат калия. Иногда применяется также растительная зола, содержащая калий главным образом в виде карбоната.
Подобно натрию, калий образует соли со всеми кислотами. Важнейшие из них были рассмотрены при описании свойств соответствующих кислот.
Как и натрий, калий содержится во всех тканях организма человека. Но, в отличие от натрия, калий в преобладающем количестве находится внутри клеток. Ион калия играет важную роль в некоторых физиологических и биохимических процессах, например, он участвует в проведении нервных импульсов. Определенная концентрация калия в крови необходима для нормальной работы сердца. В организм калий поступает главным образом с растительной пищей; суточная потребность взрослого человека в нем составляет 2—3 г.
ПОДГРУППА МЕДИ
К подгруппе меди относятся три элемента — медь, серебро и золото. Подобно атомам щелочных металлов, атомы всех этих элементов имеют в наружном слое по одному электрону; но предпоследний их электронный слой содержит, в отличие от атомов щелочных металлов, восемнадцать электронов. Структуру двух внешних электронных оболочек атомов этих элементов можно изобразить формулой (я—l)s2(n—l)p6(n—l)d10nsl (где л — номер периода, в котором находится данный элемент). Все элементы подгруппы меди — предпоследние члены декад d-элементов. Однако, как видно из приведенной формулы, их атомы содержат на (п—1)d-подуровне не 9, а 10 электронов. Это объясняется тем, что структура (п—l)ii10s' более устойчива, чем структура (п — l)d9s2 (см. стр. 93).
В табл. 31 приведены некоторые физические константы, характеризующие элементы подгруппы меди.
Сравнивая данные табл. 31 с соответствующими величинами для щелочных металлов (табл. 30), можно видеть, что радиусы атомов меди, серебра и золота меньше радиусов атомов металлов главной подгруппы. Это обусловливает значительно большую плотность, высокие температуры плавления и большие величины энтальпии атомизации рассматриваемых металлов; меньшие по размеру атомы располагаются в решетке более плотно, вследствие чего силы притяжения между ними велики.
Малый радиус атомов объясняет также более высокие значения энергии ионизации металлов этой подгруппы, чем щелочных металлов. Это приводит к большим различиям в химических 
свойствах металлов обеих подгрупп. Элементы подгруппы меди — малоактивные металлы. Они с трудом окисляются, и, наоборот, их ионы легко восстанавливаются; они не разлагают воду, гидроксиды их являются сравнительно слабыми основаниями. В ряду напряжений они стоят после водорода. В то же время восемнадцатиэлек-тронный слой, устойчивый у других элементов, здесь еще не вполне стабилизировался и способен к частичной потере электронов. Так, медь наряду с однозарядными катионами образует и двухзаряд-ные, которые для нее даже более характерны. Точно так же для золота степень окисленности +3 более характерна, чем +1. Степень окисленности серебра в его обычных соединениях равна +1; однако известны соединения со степенью окисленности серебра +2 и +3.
200. Медь. (Cuprum). Общее содержание меди в земной коре сравнительно невелико [0,01% (масс.)], однако она чаще, чем другие металлы, встречается в самородном состоянии, причем самородки меди достигают значительной величины. Этим, а также сравнительной легкостью обработки меди объясняется то, что она ранее других металлов была использована человеком.
В настоящее время медь добывают из руд. Последние, в зависимости от характера входящих в их состав соединений, подразделяют на оксидные и сульфидные. Сульфидные руды имеют наибольшее значение, поскольку из них выплавляется 80 % всей добываемой меди.
Важнейшими минералами, входящими в состав медных руд, являются: халькозин, или медный блеск, Cu2S; халькопирит, или медный колчедан, CuFeSa; малахит (СиОН)2С03.
В СССР богатые месторождения медных руд находятся на Урале, в Казахстане и в Закавказье.
Медные руды, как правило, содержат большое количество пустой породы, так что непосредственное получение из них меди экономически невыгодно. Поэтому в металлургии меди особенно важную роль играет обогащение (обычно флотационный метод), позволяющее использовать ряды с небольшим содержанием меди.
Выплавка меди из ее сульфидных руд или концентратов представляет собою сложный процесс. Обычно он слагается из следующих операций: обжиг, плавка, конвертирование, огневое и электролитическое рафинирование. В ходе обжига большая часть сульфидов примесных элементов превращается в оксиды. Так, главная примесь большинства медных руд пирит FeS2 превращается в Fe203. Газы, отходящие при обжиге, содержат S02 и используются для получения серной кислоты.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 487; Нарушение авторских прав?; Мы поможем в написании вашей работы!