
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Характеристика вагонов 81-717(714) 30 страница
|
|
|
|
Рассмотрим подробнее процесс кристаллизации расплава. Пусть это будет расплав, содержащий 40 % Sb и 60 % РЬ (точка к на рис. 147). При охлаждении этого расплава до 395 °С (точка /) из него начнут выпадать кристаллы. Это будут кристаллы избыточного по сравнению с эвтектикой компонента, в данном случае — сурьмы. Теперь сплав стал двухфазным. На диаграмме состояния ему отвечают две точки: точка / (расплав) и точка т (кристаллы сурьмы). Кристаллизация некоторого количества сурьмы изменит состав расплава; он станет беднее сурьмой и, следовательно, богаче свинцом. Точка на диаграмме, отвечающая расплаву, сместится немного влево. Поскольку охлаждение продолжается, эта точка вновь дойдет до кривой — из расплава снова выпадет какое-то количество кристаллов сурьмы. Таким образом, по мере охлаждения и кристаллизации точка, отвечающая расплаву, двигается вниз и влево по кривой кристаллизации сурьмы, а точка, отвечающая кристаллам сурьмы, — вниз по правой вертикальной оси. Когда расплав достигнет эвтектического состава, из него станут выпадать очень мелкие кристаллы обоих компонентов (эвтектика), пока не закристаллизуется все взятое количество вещества. Получившийся сплав будет представлять собою смесь эвтектики с кристаллами сурьмы.
Если исходить из расплава, содержащего небольшое количество сурьмы (меньше эвтектического), то весь процесс будет происхо-дить аналогично рассмотренному, с той разницей, что вначале будут выпадать кристаллы не сурьмы, а свинца. Полученный сплав будет иметь структуру, представляющую собой смесь эвтектики с кристаллами свинца. Наконец, если исходить из расплава эвтектического состава, то весь сплав закристаллизуется при 246 °С и будет представлять собой эвтектику. На рис. 148 показана структура сплавов системы Pb—Sb.
Если верхние кривые диаграммы на рис. 147 (АЕ и BE) показывают температуру начала кристаллизации, то нижняя — горизонталь, проходящая через точку Е, — показывает температуру окончания кристаллизации сплава. Как видно, для систем,

.... - •-'■*,?Л;
Рис. 148. Структура сплавов свинца о сурьмой:
а — сплав, содержащий избыток свинца; б — эвтектический сплав; в — сплав, содержащий избыток сурьмы.
имеющих диаграммы рассматриваемого типа, температура окончания кристаллизации не зависит от состава сплава.
При плавлении твердых сплавов горизонталь, проходящая через точку Е, показывает температуру начала плавления. В рассматриваемом случае эта температура не зависит от состава сплава, потому что плавление начинается с эвтектики, входящей в состав всех сплавов системы (кроме индивидуальных компонентов). При этом температура сплава будет оставаться постоянной, пока вся имеющаяся в нем эвтектика не расплавится. Дальнейшее нагревание приведет к повышению температуры — начнут плавиться кристаллы чистого компонента, которые находились в исходном сплаве в смеси с эвтектикой. Состав расплава будет обогащаться этим компонентом, и точка, отвечающая расплаву, будет двигаться по соответствующей ветви верхней кривой. Когда плавление закончится, т. е. когда твердая фаза исчезнет, тогда состав расплава станет таким же, каким был состав исходного сплава. Таким образом, если исходить из твердого сплава, то горизонталь, проходящая через точку Е, показывает температуру начала, а кривые АЕ и BE—-окончания плавления.
Из сказанного ясно, что области / на диаграмме рис. 147 отвечает расплав, областям // и /// соответствует сосуществование расплава с кристаллами избыточного компонента, областям IV и V отвечает смесь эвтектики с зернами свинца (область /V) или сурьмы (область V).
Как уже говорилось, по горизонтальной оси диаграмм состояния откладывается состав взятого сплава. Однако для областей, отвечающих равновесию двух фаз, по этой оси можно также устанавливать составы этих фаз. Пусть, например, сплав 5 % Sb и 95 % Pb нагрет до 270 °С. Такому сплаву отвечает точка а на диаграмме состояния (рис. 149). Проведем через эту точку горизонталь до пересечения с ближайшими линиями диаграммы. Мы получим точки b и с. Они показывают, что взятому сплаву при 270 °С отвечает равновесие кристаллов свинца (точка Ь) с расплавом, состав котооого определяется абсциссой точки с (приблизительно 10 % Sb и'90 % Pb).
Диаграмма состояния для сплавов с неограниченной растворимостью в твердом состоянии, На рис. 150 приведена диаграмма состояния системы Ag—Au, представляющая собой простейший пример диаграмм этого типа. Как и в предыдущих случаях, точки А и В показызают температуры плавления компонентов. Вид кривых плавления (нижняя кривая) и затвердевания (верхняя кривая) обусловлен в этом случае тем, что кристаллы, выделяющиеся при охлаждении расплава, всегда содержат оба компонента (кроме, конечно, кристаллизации чистых серебра или золота).
Рассмотрим, как происходит кристаллизация расплавов в этом случае. Пусть исходный жидкий сплав соответствует точке d на.
то

Рис. 153. Диаграмма состояния системы Ag
- Au.
диаграмме (рис. 150). Прн охлаждении его до температуры h (точка е) начинается кристаллизация. Кристаллы представляют собой твердый раствор, более богатый тугоплавким компонентом— золотом (точка р). Поэтому в ходе кристаллизации жидкая фаза обедняется тугоплавким компонентом, и точка диаграммы, отвечающая расплаву, смещается несколько влево. По мере охлаждения эта точка движется вниз, вновь доходит до кривой и процесс кристаллизации продолжается. Таким образом, охлаждение расплава сопровождается выпадением кристаллов твердого раствора, обогащенных тугоплавким компонентом — золотом, и обогащением расплава легкоплавким компонентом — серебром. Соответствующие точки на диаграмме при этом перемещаются: состав жидкой фазы изменяется по верхней линии, а состав' твердого раствора — по нижней. При медленном проведении процесса кристаллизация заканчивается по достижении такой температуры t2, при которой образующиеся кристаллы имеют состав исходного сплава (точка г).
Таким образом, области / на диаграмме состояния рассматриваемой системы (рис. 150) отвечает расплав, области // — сосуществование расплава и кристаллов твердого раствора, области /// — твердый раствор. При равновесии точки обеих кривых на диаграмме связаны между собой: каждой температуре отвечает расплав определенного состава и кристаллы тоже определенного состава, но другого, чем состав расплава (например, точке е отвечает точка р).
В ходе процесса кристаллизации температура системы понижается и равновесие между расплавом и кристаллами, образовавшимися ранее, т. е. при более высокой температуре, нарушается. Поэтому кристаллизация сопровождается диффузией, в результате чего при медленном проведении процесса зерна всего сплава получаются однородными и имеют одинаковый состав. При быстром охлаждении процессы диффузии не успевают происходить и сплав получается неоднородным.

Как и в предыдущем случае, по горизонтальной оси диаграммы можно устанавливать составы равновесных фаз, в данном случае— расплава и находящегося в равновесии с ним твердого рас-твора. Например, система, которой отвечает точка s, состоит из расплава, состав которого отвечает точке е, и кристаллов состава, соответствующего точке р.
Диаграмма состояния для сплавов с ограниченной' взаимной растворимостью в твердом состоянии. В сплавах этого типа, образуемых компонентами X и У, могут существовать жидкая фаза и два твердых раствора: раствор компонента X в У и раствор компонента У в X. В простейшем случае эти два твердых раствора образуют эвтектику; к такому типу принадлежит система Pb—Sn, диаграмма состояния которой приведена иа рис. 151. Отметим прежде всего, что области / здесь отвечает расплав, области // — твердый раствор олова в свинце, области /// — твердый раствор свинца в олове.
Для того чтобы понять, существованию каких фаз отвечают другие области на диаграмме и кривые на ней, рассмотрим, как протекает в системе данного типа кристаллизация расплавов.
Сначала будем исходить из жидкого сплава, богатого свинцом (точка d на рис. 151). При охлаждении этого расплава до температуры ti (точка е) начнется выделение кристаллов твердого раствора олова в свинце. Состав этих кристаллов отвечает точке р; они богаче свинцом, чем исходный расплав, так что при кристаллизации расплав обедняется свинцом. Как и в предыдущих случаях, точки на диаграмме, отвечающие расплаву и образующимся кристаллам, перемещаются: состав жидкой фазы изменяется по линии АЕ, а состав кристаллов — по линии AD. По достижении температуры г2 (точка г) образующиеся кристаллы имеют состав исходного сплава. Если процесс проводится достаточно медленно, то при температуре г2 кристаллизация заканчивается, подобно тому, как это происходит в системах с неограниченной взаимной растворимостью (см. выше).
Кривая ADF показывает растворимость олова в твердом свинце при различных температурах. Видно, что растворимость максимальна при 183,3 °С. Поэтому при охлаждении кристаллов до температуры гз (точка s) твердый раствор делается насыщенным. В нем начнет протекать превращение в твердом состоянии: кристаллы твердого раствора на основе свинца, состав которых отвечает точке s, будет превращаться в кристаллы твердого раствора на основе олова, состав которых соответствует точке а. При постоянной температуре кристаллы этих двух твердых растворов будут находиться в равновесии. Однако при дальнейшем охлаждении равновесие нарушится и превращение одних кристаллов в другие будет продолжаться. При этом кристаллы твердого раствора на основе свинца будут обедняться оловом — их состав будет изменяться по кривой DF; одновременно по кривой CG будет изменяться состав кристаллов твердого раствора на основе олова.
Теперь рассмотрим охлаждение жидкого сплава, не столь богатого свинцом (точка /). По охлаждении до температуры г4 (точка g) из расплава начнут выделяться кристаллы твердого раствора на основе свинца; их состав отвечает точке h. По мере выделения этих кристаллов, расплав обогащается оловом: его состав изменяется по линии АЕ, а состав выделяющихся кристаллов — по линии AD. Когда точка, отвечающая расплаву, достигает точки Е,— из расплава выделяются кристаллы обоих твердых растворов; при этом состав кристаллов твердого раствора на основе свинца отвечает точке D, а состав кристаллов твердого раствора на основе олова — точке С. Ясно, что точка Е представляет собой эвтектическую точку, а выделяющаяся смесь кристаллов — эвтектическую смесь.
В области температур ниже 183,3 °С растворимость свинца в олове и олова в свинце с понижением температуры уменьшается. Поэтому при дальнейшем охлаждении сплава образовавшиеся кристаллы изменяют свой состав. Состав кристаллов твердого раствора олова в свинце изменяется по кривой DF, а кристаллов твердого раствора свинца в олове —по кривой CG.
Аналогично протекает кристаллизация расплавов, богатых оловом. В этом случае кристаллизация начинается с выделения кристаллов твердого раствора на основе олова.
На основании сказанного можно заключить, что областям IV и V на диаграмме отвечает сосуществование жидкого расплава и кристаллов твердого раствора на основе свинца (область IV) или на основе олова (область V), а областям VI и VII — смеси кристаллов эвтектики с кристаллами твердого раствора на основе
 | |||||
 | 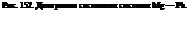 | ||||
 тальпии образования подобных лики; лишь в некоторых случаях ствии алюминия с расплавленной провождается значительным экзотермическим э металлы образуют по несколько соединений друг с другом, например, AuZn, Au3Zn5, AuZn3; Na4Sn, NaSn, NaSn2.
тальпии образования подобных лики; лишь в некоторых случаях ствии алюминия с расплавленной провождается значительным экзотермическим э металлы образуют по несколько соединений друг с другом, например, AuZn, Au3Zn5, AuZn3; Na4Sn, NaSn, NaSn2.
На рис. 152 приведена диаграмма состояния системы Mg—Pb. Эта система служит простейшим примером систем, в которых образуются химические соединения: свинец образует с магнием только одно соединение Mg2Pb, а в твердом состоянии эти металлы взаимно нерастворимы.
От рассмотренных ранее диаграмм эта диаграмма отличается наличием максимума на кривой начала кристаллизации. Этот максимум (точка С) отвечает температуре плавления соединения Mg2Pb. Абсцисса точки максимума указывает состав соединения. На диаграмме имеются две эвтектики Ei и Е2. Эвтектика £\ представляет собой смесь кристаллов Mg и Mg2Pb, а эвтектика Е2— кристаллов Pb и Mg2Pb.
Таким образом, диаграмма системы с химическим соединением как бы составлена из двух диаграмм первого типа. Если компоненты системы образуют между собой два или более химических соединения, то диаграмма как бы составлена из трех, четырех и более отдельных диаграмм первого типа.
Кристаллизация сплавов в этом и в подобных случаях происходит аналогично кристаллизации сплавов, образующих диаграммы первого типа. Отличие состоит в том, что, кроме выделения кристаллов индивидуальных компонентов, происходит еще образование кристаллов соединения. По линии АЕ^ из расплавов при охлаждении выделяется магний, по линии Е2В— свинец и по линии EiCE2 — Mg2Pb. Так, если охлаждать жидкий сплав, содержащий 40 % Pb (60 % Mg), то из него сначала будут выделяться кристаллы магния. Когда температура понизится до 460 °С, вся оставшаяся еще жидкой часть сплава начнет затвердевать при этой температуре, образуя эвтектическую смесь мельчайших кристалликов магния и химического соединения Mg2Pb.
При охлаждении жидкого сплава, содержащего 75 % РЬ, сначала будут выделяться кристаллы Mg2Pb. Это будет происходить до тех пор, пока температура не снизится до 460 °С — точки образования эвтектики. Аналогичные процессы с выделением эвтектики Ег (при 250 °С) будут протекать при содержании в сплаве более 80 % РЬ.
Нетрудно понять, что области / на рис. 152 отвечает жидкий сплаз, областям //—V—равновесия жидкого сплава и соответствующих кристаллов (в области // — кристаллы Mg, в областях III и IV — кристаллы Mg2Pb, в области V—кристаллы РЬ), а областям VI—IX — твердые сплавы [Mg -j- эвтектика Е\ (VI), Mg2Pb + эвтектика Ev (VII), Mg2Pb + эвтектика Ег (VIII), РЬ + эзтектика Ег (IX)].
Мы рассмотрели наиболее простые, но в то же время важнейшие типы диаграмм состояния. Для многих систем диаграммы состояния носят значительно более сложный характер. Так, ряд металлов и сплавов испытывают превращения в твердом состоянии, переходя из одной модификации в другую. На диаграмме состояния появляются при этом кривые, разграничивающие области устойчивости этих модификаций.
Существуют методы построения диаграмм состояния т р о й и ы х систем — систем, состоящих из трех компонентов.
Для технически важных систем диаграммы состояния изучены и приводятся в специальной литературе. Они имеют широкое применение в различных областях науки и техники, служат научной основой при подборе сплавов, обладающих заданными свойствами, при изыскании методов термической обработки сплавов, при разработке и создании новых сплавов. Примером системы, имеющей очень большое практическое значение, может служить система Fe — С. Диаграмма состояния этой системы рассмотрена в § 238.
Кроме диаграмм состояния, большое значение имеют диаграммы состав — свойство. На этих диаграммах по оси абсцисс откладывают, как и на диаграммах состояния, состав системы, а по оси ординат — величины, характеризующие различные свойства системы, например, плотность, электрическую проводимость, коррозионную стойкость и др.
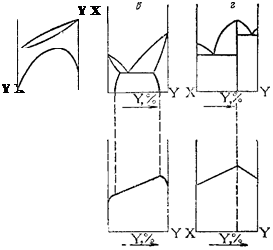
В верхней части рис. 153 схематически изображены диаграммы состояния четырех основных типов сплавов, а в нижней его части — отвечающие им типичные диаграммы — «состав—-свойство». Видно, что при образовании механической смеси (рис. 153, о) свойства сплавов изменяются линейно и их значения находятся в интервале между значениями этих свойств для индивидуальных компонентов. При образовании твердых растворов (рис. 153,6 и е) наблюдается нелинейная зависимость. При этом некоторые свойства могут значительно отличаться от свойств металлов, составляющих сплав. Наконец, при образовании химического соединения на диаграммах «состав — свойство» появляется максимум или минимум, отвечающий соединению (рис. 153, г).
 |  | ||
XL__.
Y,%
-YX
Рис. 153. Типичные диаграммы состояния и вид соответствующих диаграмм «состав -ство» (схема).
свой-
Метод построения диаграмм «состав — свойство» был положен II. С. Кур-наковым * в основу разработанного им метода исследования систем — физико-химического анализа. В настоящее время физико-химический анализ служит одним из основных способов изучения сплавов и вообще систем, состоящих из нескольких компонентов: солей, оксидов п других.
196. Коррозия металлов. Металлические материалы — металлы и сплавы на основе металлов, — приходя в соприкосновение с окружающей их средой (газообразной или жидкой), подвергаются с той или иной скоростью разрушению. Причина этого разрушения лежит в химическом взаимодействии: металлы вступают в окислительно-восстановительные реакции с веществами, находящимися в окружающей среде, и окисляются.
Самопроизвольное разрушение металлических материалов, происходящее под химическим воздействием окружающей среды, называется коррозией (от латинского «corrodere» — разъедать).
| * Николай Семенович К у р н а к о в (1860—1941)—русский ученый, академик, лауреат Государственной премии, автор работ по теории растворов и сплавов, химии комплексных соединений, основоположник физико-химического анализа. Н. С. Курнаков уделял много внимания изучению природных соляных растворов; его работы в этой области способствовали эффективному использованию отечественных соляных ресурсов и привели к открытию месторождений калийных солей вблизи Соликамска. |
Общая масса металлических материалов, используемых в виде различных изделий в мировом хозяйстве, очень велика. Поэтому, несмотря на то, что обычно скорость коррозии мала, ежегодно из-за коррозии безвозвратно теряются огромные количества металла. По ориентировочным подсчетам мировая потеря металла от коррозии выражается величиной 20 миллионов тонн в год. Но еще больший вред связан не с потерей металла, а с порчей изделий, вызываемой коррозией. Затраты иа ремонт или иа замену деталей судов, автомобилей, аппаратуры химических производств, проборов во много раз превышают стоимость металла, из которого они изготовлены. Наконец, существенными бывают косвенные потери, вызванные коррозией. К ним можно отнести, например, утечку нефти или газа из подвергшихся коррозии трубопроводов, порчу продуктов питания, потерю здоровья, а иногда и жизни людей в тех случаях, когда это вызвано коррозией. Таким образом, борьба с коррозией представляет собой важную народнохозяйственную проблему. Поэтому на защиту от коррозии тратятся большие средства.
К важнейшим случаям коррозии относятся коррозия в газах (газовая коррозия) и коррозия в растворах электролитов (электрохимическая коррозия). Коррозия в газах происходит при повышенных температурах, когда конденсация влаги на поверхности металла невозможна. Газовой коррозии подвергаются арматура печей, детали двигателей внутреннего сгорания, лопатки газовых турбин и т. п. Газовую коррозию претерпевает также металл, подвергаемый термической обработке. В результате газовой коррозии на поверхности металла образуются соответствующие соединения: оксиды, сульфиды и др.
Для изготовления аппаратуры, подвергающейся действию кор-розионноактивных газов, применяют жаростойкие сплавы. Для придания жаростойкости стали и чугуну в их состав вводят хром, кремний, алюминий; применятотся также сплавы на основе никеля или кобальта. Защита от газовой коррозии осуществляется, кроме того, насыщением в горячем состоянии поверхности изделия некоторыми металлами, обладающими защитным действием. К таким металлам принадлежат алюминий и хром. Защитное действие этих металлов обусловлено образованием на их поверхности весьма тонкой, но прочной оксидной пленки, препятствующей взаимодействию металла с окружающей средой. В случае алюминия этот метод носит название алитирования, в случае хрома — термохромирования.
К электрохимической коррозии относятся все случаи коррозия в водных растворах. Электрохимической коррозии подвергаются, например, подводные части судов, паровые котлы, проложенные в земле трубопроводы. Коррозия металла, находящегося во влажной атмосфере, также представляет собой электрохимическую коррозию. В результате электрохимической коррозии окисление металла может приводить как к образованию нерастворимых продуктов (например, ржавчины), так и к переходу металла в раствор в виде ионов.
В воде обычно содержится растворенный кислород, способный к восстановлению;
02 + 4Н+ + 4е" = 2Н20
Кроме того, в воде присутствуют ноны водорода, также способ-, ные к восстановлению:
2Н+ + 2е~ = Н2
Растворенный кислород и ионы водорода — важнейшие окислители, вызывающие электрохимическую коррозию металлов.
Рассмотрим, какие металлы могут быть окислены растворенным в воде кислородом, и какие — нонами водорода. Потенциал, отвечающий электродному процессу
02 + 2Н+ -Ь 4е" = 2Ы20
равен (см. табл. 18 на стр. 277):
Ф = 1,229 — 0,059рН
В нейтральных средах (рН = 7) он будет иметь значение: Ф= 1,229 —0,059-7 «0,8 В
Следовательно, растворенный в Еоде или в нейтральном водном растворе кислород может окислить те металлы, потенциал которых меньше, чем 0,8 В; они расположены в ряду напряжений от его начала до серебра.
Потенциал, отвечающий электродному процессу
2Н+ + 2е~ = Н2
в нейтральной среде, равен приблизительно —0,41 В (см. стр. 282). Следовательно, ионы водорода, находящиеся в воде и в нейтральных водных средах, могут окислить только те металлы, потенциал которых меньше, чем —0,41 В, — это металлы от начала ряда напряжений до кадмия. При этом кадмий и металлы, близкие к нему в ряду напряжений, имеют на своей поверхности защитную оксид-н\ ю пленку, препятствующую взаимодействию этих металлов с водой. Поэтому число металлов, которые могут быть окислены ионами водорода в нейтральных средах, еще меньше.
Таким образом, вода, содержащая растворенный кислород, значительно опаснее в коррозионном отношении, чем вода, не содержащая его и способная окислять металлы только ионами водорода.
При использовании металлических материалов очень важным является вопрос о скорости их коррозии. Кроме природы металла п окислителя и содержания последнего, на скорость коррозии могут влиять различные примеси, содержащиеся как в самом металле, так и в коррозионной среде—в атмосфере или в растворе.
При коррозии металла, содержащего включения другого металла, могут наблюдаться, в зависимости от размеров включений, два различных случая.
Включения инородного металла очень малы. Такие включения практически ке изменяют величину потенциала основного металла в данном растворе. В этом случае ускорение коррозии может наблюдаться, если перенапряжение окислительной полуреакщш на металле включения меньше, чем на основном металле.
В качестве примера можно указать на коррозию цинка, содержащего небольшие примеси железа или меди, в соляной или в разбавленной серной кислотах. При содержании в цинке сотых долей процента какого-либо из этих металлов скорость взаимодействия его с указанными кислотами в сотни раз выше, чем в случае цинка, подвергшегося специальной очистке. Это объясняется тем, что перенапряжение выделения водорода на меди и на железе ниже, чем на цинке, а лимитирующей стадией (см. § 61) реакции
Zn + 2Н+ = Zn2+ + Н2
является именно процесс восстановления ионов водорода.
Включения инородного металла не столь малы. Потенциал таких включений отличен от потенциала оснозного металла. В этом случае, помимо величины перенапряжения окислительной полуреакции на металле включения, на скорость коррозии может повлиять поляризующее действие (см. § 104) металла включения на основной металл. Если металл включения имеет больший потенциал, чем основной металл, то последний поляризуется анодно и скорость его коррозии возрастает. Например, алюминии, содержащий включения железа или меди, корродирует значительно быстрее, чем алюминий высокой чистоты.
Скорость коррозии металла повышается также при включений в него неметаллических примесей, потенциал которых выше потенциала основного металла. Так, включения оксидов или шлаков в стали сильно снижают ее коррозионную стойкость.
Примеси, находящиеся в окружающей среде, могут адсорбироваться на поверхности металла н также каталитически влиять на коррозию, ускоряя или замедляя ее. Например, большинство сплавов железа корродирует в морской воде гораздо быстрее, чем в воде с такой же концентрацией кислорода, не содержащей хлоридов. Это обусловлено тем, что хлорид-ионы, адсорбируясь на поверхности железа, препятствуют образованию на ней защитных слоев.
Как уже говорилось (см. § 100), некоторые металлы в определенных условиях переходят в пассивное состояние — на их поверхности образуются слои или пленки, состоящие из адсорбированного кислорода, из оксида данного металла, или из его соли. Присутствие таких слоев и их структура сильно влияют на скорость коррозии металла; в ряде случаев эти слои обладают защитным действием, вследствие чего металл корродирует лишь ничтожно медленно. В условиях атмосферного воздуха пассивирующие плен-? ки образуются на хроме, никеле, алюминии, цинке.
К важным случаям электрохимической коррозии относятся коррозия в природных водах, в растворах, атмосферная коррозия, коррозия в грунте, коррозия при неравномерной аэрации, контактная коррозия.
Атмосферная к о р р о з и я — коррозия во влажном воздухе при обычных температурах. Поверхность металла, находящегося во влажном воздухе, бывает покрыта пленкой воды, содержащей различные газы, и в первую очередь — кислород. Скорость атмосферной коррозии зависит от условий. В частности, на нее влияет влажность воздуха и содержание в нем газов, образующих с водою кислоты (СО2, SO2). Большое значение имеет также состояние поверхности металла: скорость атмосферной коррозии резко возрастает при наличии на поверхности шероховатостей, микрощелей, пор, зазоров и других мест, облегчающих конденсацию влаги.
Коррозия в грунте* приводит к разрушению проложенных под землей трубопроводов, оболочек кабелей, деталей строительных сооружений. Металл в этих условиях соприкасается с влагой грунта, содержащей растворенный воздух. В зависимости от состава грунтовых вод, а также от структуры и минералогического состава грунта, скорость этого вида коррозии может быть весьма различной.
Коррозия при неравномерной аэрации** — наблюдается в тех случаях, когда деталь или конструкция находится в растворе, но доступ растворенного кислорода к различным ее частям неодинаков. При этом те части металла, доступ кислорода к которым минимален, корродируют значительно сильнее тех частей, доступ кислорода к которым больше. Такое неравномерное распределение коррозии объясняется следующим образом. При восстановлении кислорода
02 + 4Н+ + 4е~ = 2Н20
расходуются ионы водорода и раствор, следовательно, несколько подщелачивается. Металлы, и в частности железо, при подщелачи-вании раствора легче переходят в пассивное состояние. Поэтому аэрируемые участки металла переходят в пассивное состояние и скорость коррозии на них снижается. На неаэрируемых участках не происходит пассивирования — здесь протекает процесс окисления металла, приводящий к переходу его ионов в раствор:
М = Мг+ + ге'
| * Этот вид коррозии часто неточно называют почвенной коррозией, ** Аэрация — омывание воздухом, кислородом. |
Таким образом, при неравномерной аэрации металла осуществляется пространственное разделение окислительно-восстановительной реакции: восстановление кислорода протекает на более аэрируемых участках, а окисление металла — на менее аэрируемых участках поверхности. Локализация процесса окисления приводит к местной к о р р о з и и — интенсивному разрушению металла на отдельных участках. Местная коррозия приводит к появлению на поверхности металла углублений («язв»), которые со временем могут превращаться в сквозные отверстия. Иногда развитие язв трудно обнаружить, например, из-за остатков окалины на поверхности металла. Этот вид коррозии особенно опасен для обшивки судов, для промышленной химической аппаратуры и в ряде других случаев.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 399; Нарушение авторских прав?; Мы поможем в написании вашей работы!