
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Характеристика вагонов 81-717(714) 33 страница
|
|
|
|
Альфред Берн ер — швейцарский хи-
мик, лауреат Нобелевской премии, один из
создателей учения о комплексных соедине-
ниях. Научная деятельность Вернера протека-
ла в Цюрихском университете, профессором
которого он был с 1893 г. Вернер синтезиро-
вал большое число новых комплексных соеди-
нений, систематизировал ранее известные и
вновь полученные комплексные соединения и
разработал экспериментальные методы доказа-
Альфред Вернер тельства их строения. Для объяснения строе-
(1866—19191 ния 15 своиств комплексных соединении Вернер
* ' выдвинул идею о координации, т. е. о про»
странствеином окружении иоиа металла анионами или нейтральными молекулами. Координационная теория легла в основу современных представлений о комплексных соединениях.
203. Основные положения координационной теории. Согласно координационной теории, в молекуле любого комплексного соединения один из ионов, обычно положительно заряженный, занимает центральное место и называется комплексообразовате-л е м или центральным ионом. Вокруг него в непосредственной близости расположено или, как говорят, координировано некоторое число противоположно заряженных ионов или электронейтральных молекул, называемых лигандамн (или аддендами)' и образующих внутреннюю координационную сферу соединения. Остальные ионы, не разместившиеся во внутренней сфере, находятся на более далеком расстоянии от центрального иона, составляя внешнюю координационную сферу. Число лигандов, окружающих центральный ион, называется координационным числом.
Внутренняя сфера комплекса в значительной степени сохраняет стабильность при растворении. Ее границы показывают квадрат-ными скобками. Ионы, находящиеся во внешней сфере, в растворах легко отщепляются. Поэтому говорят, что во внутренней сфере ионы связаны неионогенно, а во внешней — и о н о г е н н о. Например, координационная формула комплексной соли состава PtCU-2KCl такова: Кг[Р1С16]. Здесь внутренняя сфера состоит из. центрального атома платины в степени окисленности +4 и хлорид-ионов, а ионы калия находятся во внешней сфере.
Не следует думать, что комплексные соединения всегда построены из ионов; в действительности эффективные заряды атомов
и молекул, входящих в состав комплекса, обычно невелики. Более правильно поэтому пользоваться термином «центральный атом». Ионные представления о природе связи в комплексных соединениях носят в некоторой степени формальный характер, однако они удобны для классификации и определения зарядов комплексов и позволяют качественно предсказать некоторые их свойства.
Координационная теория Вернера является руководящей в химии комплексных соединений и в настоящее время. С течением времени изменяются и уточняются лишь представления о силах, действующих между центральным атомом и лигандами (см. § 206). Широкое распространение этой теории объясняет, почему комплексные соединения часто называют «координационными соединениями».
Существует ряд методов установления координационных формул комплексных соединений.
С помощью реакций двойного обмена. Именно таким путем была доказана структура следующих комплексных соединений платины: PtCl4-6NH3, PtCl4-4NH3, PtCl4-2NH3, PtCl4-2KCl.
Если подействовать на раствор первого соединения раствором AgN03, то весь содержащийся в нем хлор осаждается в виде хлорида серебра. Очевидно, что все четыре хлорид-иона находятся во внешней сфере и, следовательно, внутренняя сфера состоит только из молекул аммиака. Таким образом, координационная формула соединения будет [Pt(NH3)6]Cl4. В соединении PtCl4-4NH3 нитрат серебра осаждает только половину хлора, т. е. во внешней сфере находятся только два хлорид-иона, а остальные два вместе с четырьмя молекулами аммиака входят в состав внутренней сферы, так что координационная формула имеет вид [Pt(NH3)4Cl2] С12. Раствор соединения PtCl4-2NH3 не дает осадка с AgN03, это соединение изображается формулой [Pt (NH3)2C14]. Наконец, из раствора соединения PtCl4-2KCl нитрат серебра тоже не осаждает AgCl, но путем обменных реакций можно установить, что в рас* творе имеются ионы калия. На этом основании строение его изображается формулой Кг [PtCle] -
| * Молярная электрическая проводимость раствора ц равна электрической проводимости объема раствора, содержащего 1 моль вещества и заключенного между электродами, находящимися на расстоянии в I см друг от друга. Значения ц выражаются в Ом~1'См2-моль-1, |
По молярной электрической проводимости разбавленных растворов*. При сильном разбавлении молярная электрическая проводимость [х комплексного соединения определяется зарядом и числом образующихся ионов. Для соединений, содержащих комплексный ион и однозарядные катионы или анионы, имеет место следующее примерное соотношение:
Число ионов, на которые и. Число ионов, на которые „
распадается молекула „ -1 „„2 „.„.-» распадается молекула n -1 2,„„„ -1
электролита °м -см -моль электролита °м -см -моль
2 100 4 400
3 250 5 500
Измерение электрической проводимости подтверждает приведенные выше координационные формулы комплексов платины. Электрическая проводимость их изменяется, как показано на диаграмме (рис. 155). Для первого соединения ц. ж 500, что указывает на образование при его диссоциации пяти ионов и соответствует координационной формуле [Pt (NH3) 6] С14. По мере замещения во внутренней сфере молекул NH3 на ионы СЬ электрическая проводимость падает и становится минимальной для неэлектролита [Pt(NH3)2Cl4]. При переходе к соединению Кг [PtCl6] электрическая проводимость вновь возрастает, а значение ее соответствует образованию при диссоциации трех ионов.
Рентгеноструктурным методом. Координационная формула комплексного соединения, находящегося в кристаллическом состоянии, может быть непосредственно установлена путем определения взаимного положения атомов и молекул в кристалле рентгеноструктурным методом (см. § 50). Однако для этого требуется вырастить достаточно крупный и неискаженный кристалл комплексного соединения, что не всегда возможно.
Существует и ряд других физико-химических методов установления координационных формул комплексных соединений.
Анализируя координационные числа многих комплексных соединений, А. Вернер пришел к выводу, что заряд центрального иона (или, точнее, степень окисленности центрального атома) является основным фактором, влияющим на координационное число. Ниже сопоставлены наиболее характерные координационные числа в растворах и заряд центрального иона:
Заряд центрального иона +1 +2 +3 +4
Координационное число 2 4, 6 6, 4 8
Здесь выделены жирным шрифтом чаще встречающиеся коор-
динационные числа в тех случаях, когда возможны два различных
типа координации. Координационное число 6 встречается в ком-
lS2j плексных соединениях Pt4+, Сг3+, Со3+,
| | 400 300 |
508% Fe3+, координационное число 4 — в
комплексах Cu2+, Zn2+, Pd2+, Pt2+, ко-
ординационное число 2 — в комплек-
сах Ag+, Cu+. Приведенные координа-
224 P25S Ционные числа соответствуют макси-
мальному насыщению координацион-
Рис. 155. Изменение молярной электрической проводимости и, в ряду комплексных соединении плати-вы(1У):
1 —lPt<NH3)eVCW; 2—lPt(NH3)4Cl2lCl2; 8—[Pt(NH3)aCl«U <-Kji[PtCIel.
ной сферы и относятся к координационно-насыщенным соединениям. Не всегда в растворах соблюдаются условия, необходимые для этого, и тогда образуются координационно-ненасыщенные комплексы с меньшими координационными числами.
Координационное число не является неизменной величиной для данного комплексообразователя, а обусловлено также природой лиганда, его электронными свойствами. Даже для одних и тех же комплексообразователей и лигандов координационное число зависит от агрегатного состояния, от концентрации компонентов и температуры раствора.
Лиганды, занимающие во внутренней координационной сфере одно место, называются м о н о д е нт а т ны м и. Существуют лиганды, занимающие во внутренней сфере два или несколько мест, Такие лиганды называются би- и полидентатными.
Примерами бидентатных лигандов могут служить оксалатный
(о О \
^ (II II
ион С20| чили —О—С—С—о—/ и молекула этилендиамина (NH2CH2CH2NH2). Четырехдентатным лигандом является двухза-рядный анион этилендиаминтетрауксусной кислоты:
.. /СН2СОО-
ch2-n(
ХСН2СООН
„ ХН2СООН СН2—W
\сн2соо~
Заряд комплексного иона равен алгебраической сумме зарядов составляющих его простых ионов. Например:
Ag+ + 2CN- —> [Ag(CN)2r (4-1 — 2 = —1) Pt4+ + 6Cr —► [PtCl6]2~ (+4-6=-2)
Входящие в состав комплекса электронейтральные молекулы, например NH3, Н20, С2Н4, не влияют на величину его заряда. Поэтому при определении заряда комплексных ионов их можно не учитывать. Заряд комплексообразователя, в свою очередь, легко находится, исходя из заряда комплексного иона и зарядов содержащихся в комплексе лигандов.
Нейтральные молекулы или анионы, находящиеся во внутренней сфере комплексного соединения, могут быть последовательно замещены другими молекулами или анионами. Например, путем замещения молекул аммиака в комплексной соли [Co(NH3)6] CI3 ионами NCV получают следующие соединения: [Со (NH3) 5 (N02) ] CI2, j[Co(NH3)3(N02)3], K2[Co(NH3) (N02)5], Кз[Co(N02)6]. Понятно, что при таком замещении постепенно изменяется и заряд ком-, плексного иона, понижаясь от +3 у иона [Co(NH3)6]3+ до —3 у Иона [Co(N02)6]3-,

Простейший их представитель — амииоуксусная кислота (глицин)' NH2CH2COOH —образует хелаты с ионами Cu2+, Pt2+, Rh3+, например:
и.г_ н.м
Н2С—H2N^ ^NH2—СН2
о=с-
-су х0-
-с=о
Известны также комплексы с более сложными амннокарбоно-выми кислотами и их аналогами. Такие лиганды называются ком-плексонами. Двухзарядный анион этилендиамиптетрауксусной кислоты, называемый в виде двунатриевой соли комплексоном III, или трилоном Б, дает с двухвалетным- металлом комплекс типа:
ШОСН,С\
/СН.СООН
Ж
Ж
Н,С:
;Cir,
С с
о
о
 Хелатные соединения отличаются особой прочностью, так как центральный атом в них как бы «блокирован» циклическим лиган-дом. Наибольшей устойчивостью обладают хелаты с пяти- и ше-стичленными циклами. Комплексоны настолько прочно связывают катионы металлов, что при их добавлении растворяются такие плохо растворимые вещества, как сульфаты кальция и бария, окса-латы и карбонаты кальция. Поэтому их применяют для умягчения воды, для маскировки «лишних» ионов металла при крашении и изготовлении цветной пленки. Большое применение они находят и в аналитической химии.
Хелатные соединения отличаются особой прочностью, так как центральный атом в них как бы «блокирован» циклическим лиган-дом. Наибольшей устойчивостью обладают хелаты с пяти- и ше-стичленными циклами. Комплексоны настолько прочно связывают катионы металлов, что при их добавлении растворяются такие плохо растворимые вещества, как сульфаты кальция и бария, окса-латы и карбонаты кальция. Поэтому их применяют для умягчения воды, для маскировки «лишних» ионов металла при крашении и изготовлении цветной пленки. Большое применение они находят и в аналитической химии.
Многие органические лиганды хе-латного типа являются весьма чувствительными и специфическими реагентами на катионы переходных металлов. К ним относится, например, диметилглиоксим, предложенный Л. А. Чугаевым как реактив на ионы Ni2+ и Pd2+.
Лев Александрович Чугаев принадлежит к числу наиболее выдающихся советских химиков. Родился в Москве, в 1895 г. окончил Московский университет. В 1904—• 1908 г. — профессор Московского высшего технического училища, в 1908—1922 г. — профессор неорганической химии Петербургского университета и одновременно (с 1909 г.) —• профессор органической химии Петербургского технологического института. Занимался изучением химии комплексных соединений переходных металлов, в особенности металлов платиновой группы. Открыл много новых комплексных соединений, важных в теоретическом и практическом отношениях. Чугаев впервые обратил внимание на особую устойчивость 5- и 6-членных циклов во внутренней сфере комплексных соединений и охарактеризовал кислотно-основные свойства аммиакатов платины (IV). Он был одним из основоположников применения органических реагентов в аналитической химии. Много внимания уделял организации и развитию промышленности по добыче и переработке платины и платиновых металлов в СССР. Создал большую отечественную школу химикоз-иеоргаников, работающих в области изучения химии комплексных соединений.
Большую роль играют хелатиые соединения и в природе. Так, гемоглобин состоит из комплекса — гема, связанного с белком — глобином. В геме центральным ионом является ион Fe2+, вокруг которого координированы четыре атома азота, принадлежащие к сложному лнганду с циклическими группировками. Гемоглобин обратимо присоединяет кислород и доставляет его из легких по кровеносной системе ко всем тканям. Хлорофилл, участвующий в процессах фотосинтеза в растениях, построен аналогично, но в качестве центрального иона содержит Mg2+.
Все перечисленные классы комплексных соединений содержат один центральный атом, т. е. являются одноядерными. Встречаются комплексы и более сложной структуры, содержащие два или несколько центральных атомов одного и того же или разных элементов. Эти комплексы называются поли (много) ядерны-м и.
Существуют различные типы полиядерных комплексов.
Комплексы с мостиковыми атомами или группами атомов,
например с мостиковыми атомами хлора —CI: —>- (хлоро-), кислорода
Н Н
■—О— (оксо-), с мостиковыми группами —N: —>• (амино), —О: > (гидр-
* Н
оксо). Так, комплекс [Cr(NH3)5 —ОН —-*- (NH3)5Cr]Cl5 является биядернььм комплексом с одной мостиковой гидроксогруппон. К подобным соединениям относится и ди.мер А12С1е (см. стр. 615).
Комплексы кластерного типа, в которых атомы металла непосредственно связаны друг с другом. Это наблюдается, например, в димерах (CO)sMn — Mn(CO)s, [Re2H2Cl8j2-. В последнем соединении между атомами рения имеется тройная связь:
- СЦ уС1 С1у уС1 -.2-
Н—Re Re—Н
- Cl/ ^Cl ci/ \ci -
К многоядериым соединениям относятся также изополи- н гетерополи-кислоты.
Изополи кислоты образуются при соединении двух или нескольких кислотных остатков одной и той же кислородной кислоты за счет кислородных мостиков. В их число входят двухромовая Н2Сг07, пирофосфориая Н4Р207,
тетраборная Н2В4О7 кислоты, а также поликремнневые кислоты, составляющие основу силикатов.
Гетеропол п кислоты содержат не менее двух различных кислот или оксидов (производных неметалла и металла) и большое количество воды (до 30 молекул). Наиболее важное значение в аналитической химии имеют следующие гетерополнкпслоты:
Н3РО4 • 12Мо03 • яН20 — фосфорномолпбденовая Н3РО4 • 12W03 • (гН20 — фосфорновольфрамовая H4S1O4 • 12Мо03 • «Н20 — кремнемолибденовая H4Si04 • I2WO3 • «Н20 — кремиевольфрамовая
Известно немного комплексов, в которых центром координации является анион, — это п о л и г а л о г е н и д ы, содержащие анионы [I-xIJ- (где х меняется от 1 до 4) или [Br-xBrj- (где х 1 или 2); существуют и смешанные полпгалогенндные анионы — [I-Вгг]-, [1-С12]~. Большую роль при их образовании играет поляризация: чем больше интенсивность поляризационного взаимодействия между анионом Э~ и молекулой Э2, тем устойчивее комплекс. Именно поэтому наиболее устойчивыми из них оказываются полииодиды (молекулы 12 легко поляризуются), а полифториды не получены. Вследствие наличия в растворе равновесия
Ц *=ь Г + 12
раствор полииодида обнаруживает свойства свободного иода.
Существует много способов образования названий комплексных соединений, в том числе и традиция называть их по фамилиям исследователей, их открывших. Такой способ, хотя и отдает дань уважения ученым, сложен для запоминания. Мы приведем номенклатуру главнейших типов комплексных соединений, основанную на рекомендациях Международного союза теоретической и прикладной химии.
Название комплексного аниона начинают с указания состава внутренней сферы.
Во внутренней сфере, прежде всего называют анионы, прибавляя к их латинскому названию окончание «о». Например: С1~ —
хлоро, CN- — циано, SO2- — сульфито, ОН- — гидроксо и т. д. Далее называют нейтральные лиганды. При этом пользуются терминами: для координированного аммиака — аммин, для воды — аква. Число лигандов указывают греческими числительными: / — моно (часто не приводится), 2— ди, 3 — три, 4 — тетра, 5 — пента, 6 — гекса. Затем называют комплексообразователь, используя корень его латинского названия и окончание ат, после чего римскими цифрами указывают (в скобках) степень окисленности комплексо-образователя. После обозначения состава внутренней сферы называют внешнесферные катионы. В случае неэлектролитов степень окисленности центрального атома не приводят, так как она однозначно определяется, исходя из электронейтральности комплекса. Если центральный атом входит в состав катиона, то используют
русское название элемента и в скобках указывают его степень окисленности. Приведем примеры:
K[Fe(NH3)2 (CN)4] — тетрациаиодиамминферрат(1П) калия
(NH4)2[Pt(OH)2Cl4] — тетрахлородигндроксоплатинат(1У) аммония
[Cr(H20)3F3] — трнфторотриаквахром
(Co(NH3)3 (N02)2C1] — хлородиннтритотриамминкобальт
[Pt(NH3)4Cl2]Cl2 — хлорид днхлоротетраамми:-'платнны(1У)
[Ag(NH3)2]Cl —хлорид дпаммннсеребра(1)
205. Пространственное строение и изомерия комплексных соединений. Одинаковые лиганды симметрично располагаются в пространстве вокруг центрального атома. Чаще встречаются четные координационные числа — 2, 4, 6. Им соответствуют следующие геометрические конфигурации:
Координационное число
Геометрическая конфигурация
- линейная
 | |||
 | |||
• октаэдрнческая, схематически изображаемая так:
Г'.
Впервые правильные представления о пространственном строении комплексных соединений были сформулированы А. Вернером. При этом он исходил из найденного опытным путем числа изомеров при наличии двух или более различных лигандов в комплексе и сравнивал его с возможным числом для той или иной предполагаемой конфигурации. Так, для координационного числа 4 и тет-раэдрической конфигурации все положения лигандов относительно
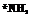 |
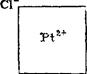
 |
H3N
Рис. 158. Пространственное строение изомеров [Pt^Ni^gClj]; слева—грякс-изомер; справа—цис-изомер.
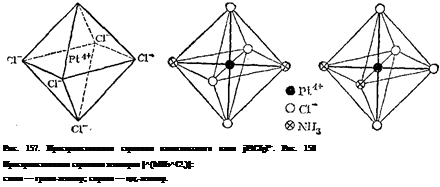 |
центрального атома эквивалентны. Поэтому тетраэдрические комплексы типа [МА2В2] (где М — центральный атом, а А и В — ли-ганды) не имеют изомеров. Другое наблюдается в комплексах платины (II); например, [Pi(NH3)2Cl2] встречается в двух изомерных формах, отличающихся по цвету, растворимости, дипольному моменту, реакционной способности и способам получения. Отсюда был сделан вывод о расположении лигандов по квадрату вокруг центрального атома, так как именно для этой конфигурации у соединений типа [МА2В2] должно иметься два изомера. В одном из изомеров комплекса [Pt (NH3)2C12] атомы хлора разделены центральным атомом (гранс-изомер), а в другом (^ис-изомер) они находятся рядом друг с другом, по одну сторону от центрального атома (рис. 156).
При увеличении числа различных заместителей число изомеров растет и для соединений типа [MABCD] для квадратной конфигурации возможно уже три изомера.
Изучая явления изомерии комплексных соединений с координационным числом 6, Вернер пришел к выводу, что в этом случае лиганды должны быть симметрично расположены вокруг центрального иона, образуя фигуру правильного октаэдра (рис. 157). Если все координированные группы одинаковы, как показано на рисунке, то, конечно, перестановка одной группы на место другой не изменит структуры комплекса. Но если группы не одинаковы, то возможно различное их расположение, вследствие чего могут образоваться изомеры. И действительно, опыт показывает, что, например, соединение [РтДЫНзЬСЦ] (где координационное число платины равно 6) существует в двух изомерных формах, отличающихся одна от другой по своей окраске и другим свойствам. Строение этих изомеров, по Вериеру,схематически показано на рис. 158. В одном случае молекулы NH3 помещаются у противоположных вершин октаэдра (гдамс-изомер), в другом — у соседних (цис-то-мер). Подобного рода пространственная изомерия наблюдается и
 PiiC. 159. Кристаллическая решетка K2[PtCl6].
PiiC. 159. Кристаллическая решетка K2[PtCl6].
у ряда других комплексов с шестью лпгандами во внутренней сфере.
| К ОМ' |
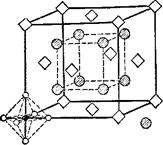
Предположения Вернера относительно октаэдрнческого строения комплекса с координационным числом 6 блестяще подтвердились при рентгенографическом исследовании кристаллов соответствующих соединений. На рис. 159 изображена кристаллическая решетка комплексной соли K2[PtCl6]. В ней комплексные ионы [PtCl6]2~ находятся в вершинах и центрах граней куба, причем хлорид-ионы в комплексе расположены в вершинах правильного октаэдра. Таким образом, ион [РЮб]2-не только сохраняется в растворах, но н является самостоятельной структурной единицей в кристаллической решетке.
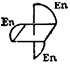
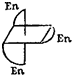
К геометрической изомерии можно отнести и зеркальную (оптическую) изомерию, рассмотренную ранее (стр. 446) на примерах органических соединений. Например, комплексы [СоЕп3]С13 (En — этилендиамин) и цис- [СоЕпгСЬ] С1 существуют в виде двух зеркальных антиподов:
 | |||
 |
[СоЕп3]3+
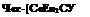 | |||
 |
Кроме геометрической изомерии, известны и другие виды изомерии комплексных соединений, обусловленные различным положением и связью лигандов во внутренней сфере. Так, гидрат пая изомерия имеет место при переходе воды из внутренней сферы во внешнюю, например [Cr(H20)5jCl3, [Сг(Н20)5С1]С12-Н20, [Сг(Н20)4С12]С1-2Н20. При этом цвет комплекса меняется от сине-фиолетового у [Сг(Н20)бТС13 до светло-зеленого у [Сг(Н20)4С19]С1 • 2Н20 (см. также § 228).
Ионизационная изомерия определяется различным распределением конов между внутренней и внешней сферами, например: [Co(NH3)5Br]S04 и [Co(NH3)5S04]Br; [Pt(NH3)4Cl2]Br2 и [Pt(NH3)4Br2]Cl2.
Координационная изомерия связана с переходом лигандов от одного комплексообразователя к другому: [Co(NH3)6][Cr('CNy и [Cr(NH3b]-,[Co(CN)6].
Имеются среди комплексных соединений и полимеры: так, составу PIC12'2NH3 отвечают изомерные цис- и транс-мономеры [Pt(NH3)2Cl2], димеры [Pt(NH3)4][PtCl4], [Pt(NH3)3Cll[Pt(NH3)Cl3] и тример [Pt(NH3)3Cl2] • •[PtCl4].
206. Природа химической связи в комплексных соединениях.
Образование многих комплексных соединений можно в первом приближении объяснить электростатическим притяжением между центральным катионом и анионами или полярными молекулами лигандов. Наряду с силами притяжения действуют и силы электростатического отталкивания между одноименно заряженными (или, в случае полярных молекул, одинаково ориентированными) лигандами. В результате образуется устойчивая группировка атомов (ионов), обладающая минимальной потенциальной энергией.
Количественные расчеты на основе такой электростатической модели впервые были выполнены В. Косселем и А. Магнусом, которые принимали ионы за недеформируемые шары и учитывали их взаимодействие по закону Кулона. Результаты этих расчетов удовлетворительно передают зависимость координационного числа от заряда центрального иона. Однако простая электростатическая теория не в состоянии объяснить избирательность (специфичность) комплексообразования, поскольку она не принимает во внимание природу центрального атома и лигандов, особенности строения их электронных оболочек. Для учета этих факторов электростатическая теория была дополнена поляризационными представлениями (см. § 46), согласно которым комплексообразованию благоприятствует участие в качестве центральных атомов небольших многозарядных катионов с?-элементов, обладающих сильным поляризующим действием, а в качестве лигандов — больших, легко поляризующихся ионов или молекул. В этом случае происходит деформация электронных оболочек центрального атома и лигандов, приводящая к их взаимопроникновению, что и вызывает упрочнение связей.
Поляризационные представления оказались полезными для объяснения устойчивости, кислотно-основных и окислительно-восстановительных свойств комплексных соединений, но многие другие их свойства остались необъясненными. Так, с позиций электростатической теории все комплексы с координационным числом 4 должны иметь тетраэдрическое строение, поскольку именно такой конфигурации соответствует наименьшее взаимное отталкивание лигандов. В действительности, как мы уже знаем, некоторые подобные комплексы, например, образованные платиной (II), построены в форме плоского квадрата. Электростатическая теория не в состоянии объяснить особенности реакционной способности комплексных соединений, их магнитные свойства и окраску. Более точное и полное описание свойств и строения комплексных соединений может быть получено только на основе квантовомеханиче-ских представлений о строении атомов и молекул.
В настоящее время существует несколько подходов к кванта-, вомеханическому описанию строения комплексных соединений,
Теория кристаллического поля основана на представлении об электростатической природе взаимодействия между центральным ионом и лигандами. Однако, в отличие от простой ионной теории, здесь учитывается различное пространственное расположение uf-орбиталей (см. рис. 20 на стр. 81) и связлиное с этим различное изменение энергии d-электронов центрального атома, вызываемое их отталкиванием от электронных облаков лигандов.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 514; Нарушение авторских прав?; Мы поможем в написании вашей работы!