
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Характеристика вагонов 81-717(714) 37 страница
|
|
|
|
Металлические свойства рассматриваемых элементов выражены слабее, чем у соответствующих элементов главных подгрупп второй и особенно первой группы, а у бора преобладают неметаллические свойства. В соединениях они проявляют степень окисленности + 3. Однако с возрастанием атомной массы появляются и более низкие степени окисленности. Для последнего элемента подгруппы— таллия — наиболее устойчивы соединения, в которых его степень окисленности равна +1.
С увеличением порядкового номера металлические свойства рассматриваемых элементов, как и в других главных подгруппах, заметно усиливаются. Так, оксид бора имеет кислотный характер, оксиды алюминия, галлия и индия — амфотерны, а оксид таллия (III) имеет основной характер.
В практическом отношении наиболее важными из элементов третьей группы являются бор и алюминий.
217. Бор (Borum). Бор сравнительно мало распространен в природе; общее содержание его в земной коре составляет около Ю-3 % (масс).
К главным природным соединениям бора относятся борная кислота Н3ВОз и соли борных кислот, из которых наиболее известна бура Na2B4O7-10H2O.
Хотя бор расположен в третьей группе периодической системы, он по своим свойствам наиболее сходен не с другими элементами этой группы, а с элементом четвертой группы — кремнием. В этом проявляется «диагональное сходство», уже отмечавшееся при рассмотрении бериллия. Так, бор, подобно кремнию, образует слабые кислоты, не проявляющие амфотерных свойств, тогда как А1(ОН)3 — амфотерное основание. Соединения бора и кремния с водородом, в отличие от твердого гидрида алюминия, — летучие вещества, самопроизвольно воспламеняющиеся на воздухе. Как и кремний, бор образует соединения с металлами, многие из которых отличаются большой твердостью и высокими температурами плавления.
Свободный бор получают восстановлением борного ангидрида В2О3 магнием. При этом бор выделяется в виде аморфного порошка, загрязненного примесями. Чистый кристаллический бор получают термическим разложением или восстановлением его гало-генидов, а также разложением водородных соединений бора. Он имеет черный цвет и среди простых веществ по твердости уступает только алмазу.
Природный бор состоит из двух стабильных изотопов: 10В и ПВ. Первый из них сильно поглощает медленные нейтроны. Поэтому бор и его соединения применяются в ядерной технике. Из них изготовляют регулирующие стержни реакторов, а также используют их в качестве материалов, защищающих от нейтронного облучения.
В металлургии бор применяется как добавка к стали и к некоторым цветным сплавам. Присадка очень небольших количеств бора уменьшает размер зерна, что приводит к улучшению механических свойств сплавов. Применяется также поверхностное насыщение стальных изделий бором — борирование, повышающее твердость и стойкость против коррозии.
Вода не действует на бор; концентрированные же серная и азотная кислоты окисляют его в борную кислоту. Например: В + 3HNO3 = Н3ВО3 + 3N02f
При комнатной температуре бор соединяется только с фтором, на воздухе он не окисляется. Если нагреть аморфный бор до 700 °С, то он загорается и горит красноватым пламенем, превращаясь в оксид; при этом выделяется большое количество теплоты: 4В + 302 = 2В203 + 2508 кДж
При высокой температуре бор соединяется со многими металлами, образуя бор иды, например, борид магния Mg3B2- Многие бориды очень тверды и химически устойчивы, причем сохраняют эти свойства при высоких температурах. Для них характерна также тугоплавкость. Например, борид циркония ZrB2 плавится при 3040 С. Благодаря таким свойствам бориды некоторых металлов применяются для изготовления деталей реактивных двигателей и лопаток газовых турбин.
При накаливании смеси бора с углем образуется карбид бора В4С Это тугоплавкое вещество (темп, плавл. около 2350 °С), обладающее очень высокой твердостью и химической стойкостью. Кар-
217. Бор
*11
б ид бора применяется для обработки твердых сплавов; его механические свойства сохраняются при высоких температурах.
С галогенами бор также реагирует при нагревании и образует вещества общей формулы ВГ3. Как уже было показано на примере BF3 (см. стр. 131), в этих соединениях бор находится в состоянии в^-гибридизаиии, образуя с галогенами плоские молекулы с углами между связями Г—В—Г, равными 120°.
Галогениды бора, как и другие соединения бора неполимерного строения, являются электронодефицитными (см. стр. 590). Так, в молекуле фторида бора во внешнем электронном слое атома бора находятся всего шесть электронов:
s F: В: F:
В этом состоянии атом бора может, следовательно, быть акцептором электронной пары. Действительно, BF3 соединяется по до-норно-акцепторпому способу с водой, аммиаком и другими веществами; известен также комплексный анион BF^. Во всех подобных соединениях ковалентность и координационное число бора равны четырем, а атом бора находится в состоянии гибридизации sps и образует тетраэдрические структуры.
Бороводороды (б ораны). При действии соляной кислоты на борид магния Mg3B2 получается сложная смесь различных бороводородов, анлогичных угле- и кремневодородам. Из этой смеси выделены в чистом виде следующие бороводороды:
B2He; B4Hio; В5Н9; В5Нц; ВвНю! ВюН^
газо- жидкие твердый
образный
Главным продуктом взаимодействия борида магния с соляной кислотой является твтраборан ВдНю — летучая жидкость (темп, кип. 18 °С) с очень неприятным запахом, пары которой воспламеняются на воздухе. При хранении тетраборан постепенно разлагается с образованием простейшего из полученных бороводородов — диборана В2Н6. Последний представляет собой газ, конденсирующийся в жидкость при —92,5 °С. На воздухе он не загорается, но водой, как и другие бороводороды, тотчас же разлагается с отщеплением водорода и образованием борной кислоты НзВОз!
В2Н6 + 6Н20 = 2Н3В03 + 6Н2
Атомы бора в молекулах бороводородов связаны друг с другом водородными «мостиками», например:
н\А/н
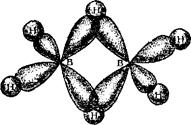
|
Рис. 164. Перекрывание атомных орбиталей в молекуле диборана.
Пунктиром на этой схеме показаны трехцентровые связи: здесь общая пара электронов занимает молекулярную орбиталь, охватывающую три атома — «мостн-ковый» атом водорода и оба атома бора. Такая орбиталь образуется вследствие перекрывания ls-орбитали атома водорода с 5р3-гибридиыми орбиталями двух атомов бора (см. рис. 164). Четыре «концевых» атома водорода связаны с атомами бора обычными двухцентровымп двухэлек-тропными связями. Таким образом, из двенадцати валентных электронов, имеющихся в атомах, составляющих молекулу диборана. восемь участвуют в образовании двухцеитровых связей В—Н, а четыре образуют две трехцентровые связи В—Н—В.
Наибольшее практическое значение имеют кислородные соединения бора.
Оксид бора, или борный ангидрид, В203 может быть получен или путем непосредственного соединения бора с кислородом, или прокаливанием борной кислоты. Это бесцветная хрупкая стекловидная масса, плавящаяся при температуре около 300 °С. Борный ангидрид очень огнестоек и не восстанавливается углем даже при белом калении. В воде он растворяется с образованием борной кислоты и выделением теплоты:
В203 + ЗН20 = 2Н3В03 + 76,5 кДж
Борная, или ортоборная, кислота Н3В03 представляет собой белые кристаллы, блестящие чешуйки которых растворяются в горячей воде. Борная кислота может быть получена действием серной кислоты на горячий раствор тетрабората натрия МагВдСЬ: Na2B40, + H2S04 + 5Н20 = Na2S04 -f 4Н3ВОэ
При охлаждении раствора борная кислота выкристаллизовывается, так как в холодной воде она малорастворима.
При кипячении раствора борной кислоты вместе с парами воды отчасти улетучивается и борная кислота. Этим объясняется ее содержание в водяных парах, выделяющихся из трещин земли в вулканических местностях.
Борная кислота принадлежит к числу очень слабых кислот (при 20°С Ki =6-Ю-10; /С2 = 2- Ю-13; Кз = 2-10~14).
При нагревании борная кислота теряет воду, переходя сначала в метаборную кислоту НВ02, а затем в борный ангидрид В203. Применяется борная кислота при приготовлении эмалей и глазурей, в производстве специальных сортов стекла, в бумажном и кожевенном производстве и в качестве дезинфицирующего средства.
Соли борных кислот — бораты — большей частью являются производными не ортоборной кислоты Н3В03, а четырехборной Н2В407 и других более бедных водой борных кислот.
Тетраборат натрия, или бура, образует большие бесцветные прозрачные кристаллы состава Na2B407- 10Н2О, которые в сухом воздухе легко выветриваются. Бура получается при взаимодействии борной кислоты с гидроксидом натрия:
4Н3В03 + 2NaOH = Na2B407 + 7Н20
Водные растворы буры вследствие гидролиза обладают сильнощелочной реакцией.
При нагревании бура теряет кристаллизационную воду и плавится. В расплавленном состоянии она растворяет оксиды различных металлов с образованием двойных солей метаборной кислоты, из которых многие окрашены в цвета, характерные для каждого металла. На этом свойстве буры основано ее применение при сварке, резании и паянии металлов. Бура широко применяется в производстве легкоплавкой глазури для фаянсовых и фарфоровых изделий и особенно для чугунной посуды (эмаль). Кроме того, она используется при изготовлении специальных сортов стекла и в качестве удобрения, поскольку бор в малых количествах необходим растениям.
218. Алюминий (Aluminium). Алюминий — самый распространенный в земной коре металл. Он входит в состав глин, полевых шпатов, слюд и многих других минералов. Общее содержание алюминия в земной коре составляет 8 % (масс).
Основным сырьем для производства алюминия служат бокситы, содержащие 32—60 % глинозема А1203. К важнейшим алюминиевым рудам относятся также алунит K2SO4• Al2(S04)3• 2А1203 • 6Н20 и нефелин Na20-Al203-2Si02.
СССР располагает запасами алюминиевых руд. Кроме бокситов, месторождения которых имеются у нас на Урале, в Башкирской АССР и в Казахстане, богатейшим источником алюминия является нефелин, залегающий совместно с апатитом в Хибинах. Значительные залежи алюминиевого сырья имеются в Сибири.
Впервые алюминий был получен Велером в 1827 г. действием металлического калия на хлорид алюминия. Однако, несмотря на широкую распространенность в природе, алюминий до конца XIX века принадлежал к числу редких металлов.
В настоящее время алюминий в громадных количествах получают из оксида алюминия А1203 электролитическим методом. Используемый для этого оксид алюминия должен быть достаточно чистым, поскольку из выплавленного алюминия примеси удаляются с большим трудом. Очищенный А1203 получают переработкой природного боксита.
Получение алюминия — сложный процесс, сопряженный с большими трудностями. Основное исходное вещество — оксид алюминия — не проводит электрический ток и имеет очень высокую.температуру плавления (около 2050 °С). Поэтому электролизу подвергают расплавленную смесь криолита[1] Na3[AlF6] и оксида алюминия. Смесь, содержащая около 10 °/о (масс.) А1203, плавится при 960 °С и обладает электрической проводимостью, плотностью и вязкостью, наиболее благоприятствующими проведению процесса. Для дополнительного улучшения этих характеристик в состав смеси вводят добавки A1F3, CaF2 и MgF2. Благодаря этому проведение электролиза оказывается возможным при 950 °С.
Электролизер для выплавки алюминия представляет собой железный кожух, выложенный изнутри огнеупорным кирпичом. Его дно (под), собранное из блоков спрессованного угля, служит катодом. Аноды (один или несколько) располагаются сверху: это — алюминиевые каркасы, заполненные угольными брикетами. На современных заводах электролизеры устанавливают сериями; каждая серия состоит из 150 и большего числа электролизеров.
При электролизе на катоде выделяется алюминий, а на аноде—-кислород. Алюминий, обладающий большей плотностью, чем исходный расплав, собирается на дне электролизера; отсюда его периодически выпускают. По мере выделения металла, в расплав добавляют новые порции оксида алюминия. Выделяющийся при электролизе кислород взаимодействует с углеродом анода, который выгорает, образуя СО и С02.
В дореволюционной России алюминий не производился. Первый в СССР алюминиевый завод (Волховский) вступил в строй в 1932 г., а уже в 1935 г. наша страна заняла по производству алюминия третье место в мире.
Одинаковое строение внешнего электронного слоя атома бора и алюминия обусловливает сходство в свойствах этих элементов. Так, для алюминия, как и для бора, характерна только степень окисленности +3. Однако при переходе от бора к алюминию сильно возрастает радиус атома (от 0,091 до 0,143 нм) и, кроме того, появляется еще один промежуточный восьмиэлектрониый слой, экранирующий ядро. Все это приводит к ослаблению связи внешних электронов с ядром и к уменьшению энергии ионизации атома (см. табл. 35). Поэтому у алюминия металлические свойства выражены гораздо сильнее, чем у бора. Тем не менее, химические связи, образуемые алюминием с другими элементами, имеют в основном ковалентный характер.
Другая особенность алюминия (как и его аналогов — галлия, индия и таллия) по сравнению с бором заключается в существовании свободных d-подуровней во внешнем электронном слое его атома. Благодаря этому координационное число алюминия в его соединениях может равняться не только четырем, как у бора, но и шести.
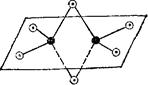
|
Рис. Н)5. Схема пространственного строения молекулы
черные кружки — атомы алюминия, светлые — атомы хлора.
Соединения алюминия типа А1Э3, как и аналогичные соединения бора, электронодефицитпьг в отдельных молекулах подобных соединений во внешнем электронном слое атома алюминия находится только шесть электронов. Поэтому здесь
атом алюминия способен быть акцептором электронных пар. В частности, для галогенидов алюминия характерно образование днмеров, осуществляемое по донорно-акцепторному способу (на схеме Г — атом галогена):
* • • •
:г: ЛЭг:
• • • • у' • • • ■
: г: Ai ^ * Ai: г:
:гаг:г: «• • *
Как видно, подобные димериые молекулы содержат по два «мостиковых» атома галогена. Пространственное строение А12С1в показано на рис. 165. Га-логениды алюминия существуют в виде димерных молекул А12Г6 в расплавах и в парах. Однако по традиции их состав обычно выражают в форме А1Г3. Ниже мы тоже будем придерживаться этого способа написания формул галогенидов алюминия.
Гидрид алюминия А1Н3 — тоже электронодефицитное соединение. Однако атом водорода, в отличие от атомов галогенов в молекулах А1Г3, не имеет неподелепной электронной пары и не может играть роли донора электронов. Поэтому здесь отдельные молекулы А1Н3 связываются друг с другом через «мостиковые» атомы водорода трехцентровыми связями, аналогичными связям в молекулах бороводородов (см. стр. 612). В результате образуется твердый полимер, состав которого можно выразить формулой (А1Н3)„.
Алюминий — серебристо-белый легкий металл. Он легко вытягивается в проволоку и прокатывается в тонкие листы.
При комнатной температуре алюминий не изменяется на воздухе, но лишь потому, что его поверхность покрыта тонкой пленкой оксида, обладающей очень сильным защитным действием. Уничтожение этой пленки, например, путем амальгамирования алюминия, вызывает быстрое окисление металла, сопровождающееся заметным разогреванием.
Стандартный электродный потенциал алюминия равен —1,663 В, Несмотря на столь отрицательное его значение, алюминий, вследствие образования на его поверхности защитной оксидной пленки, не вытесняет водород из воды. Однако амальгамированный алюминий, на котором не образуется плотного слоя оксида, энергично взаимодействует с водой с выделением водорода.
Разбавленные соляная и серная кислоты легко растворяют алюминий, особенно при нагревании. Сильно разбавленная и холодная концентрированная азотная кислота алюминий не растворяет.
При действии на алюминий водных растворов щелочей слой оксида растворяется, причем образуются алюминаты — соли, содержащие алюминий в составе аниона:
Л1203 + 2NaOH + ЗН20 = 2Na[Al(OH)4]
тетрагидроксоалю-мннат натрня
Алюминий, лишенный защитной пленки, взаимодействует с во-дой, вытесняя из нее водород:
2А1 + 6Н20 = 2А1(ОН)3 + 3H2f
Образующийся гидроксид алюминия реагирует с избытком щелочи, образуя гидроксоалюминат:
А1(ОН)3 + NaOH = Na[Al(OH)4]
Удвоив последнее уравнение и сложив его с предыдущим, получим суммарное уравнение растворения алюминия в водном растворе щелочи:
2А1 + 2NaOH + 6Н20 = 2Na[Al(OH)4] + 3H2f
Алюминий заметно растворяется в растворах солей, имеющих вследствие их гидролиза кислую или щелочную реакцию, например, в растворе Ыа2СОз.
Если порошок алюминия (или тонкую алюминиевую фольгу) сильно нагреть, то он воспламеняется и сгорает ослепительным белым пламенем, образуя оксид алюминия А120з.
Основное применение алюминия — производство сплавов на его основе. Легирующие добавки (например, медь, кремний, магний, цинк, марганец) вводят в алюминий главным образом для повышения его прочности. Широкое распространение имеют дур а л го-мины, содержащие медь и магний, силумины, в которых основной добавкой служит кремний, магналий (сплав алюминия с 9,5—11,5 % магния). Основные достоинства всех сплавов алюминия— это их малая плотность (2,5—2,8 г/см3), высокая прочность (в расчете на единицу массы), удовлетворительная стойкость против атмосферной коррозии, сравнительная дешевизна и простота получения и обработки. Алюминиевые сплавы применяются в ракетной технике, в авиа-, авто-, судо- и приборостроении, в производстве посуды и во многих других отраслях промышленности. По широте применения сплавы алюминия занимают второе место после стали и чугуна.
Алюминий — одна из наиболее распространенных добавок в сплавах на основе меди, магния, титана, никеля, цинка, железа.
В виде чистого металла алюминий используется для изготовления химической аппаратуры, электрических проводов, конденсаторов. Хотя электрическая проводимость алюминия меньше, чем у меди (около 60 % электрической проводимости меди), но это компенсируется легкостью алюминия, позволяющей делать провода более толстыми: при одинаковой электрической проводимости алюминиевый провод весит вдвое меньше медного.
Важным является применение алюминия для алитирования, которое заключается в насыщении поверхности стальных или чугунных изделий алюминием с целью защиты основного материала от окисления при сильном нагревании. В металлургии алюминий применяется для получения кальция, бария, лития и некоторых других металлов методом алюминотермии (см. § 192).
Оксид алюминия А120з, называемый также глиноземом, встречается в природе в кристаллическом виде, образуя минерал корунд. Корунд обладает очень высокой твердостью. Его прозрачные кристаллы, окрашенные примесями в красный или синий цвет, представляют собой драгоценные камни — рубин и сапфир. Теперь рубины получают искусственно, сплавляя глинозем в электрической печи. Они используются не столько для украшений, сколько для технических целей, например, для изготовления деталей точных приборов, камней в часах и т. п. Кристаллы рубинов, содержащих малую примесь Сг20з, применяют в качестве квантовых генераторов — лазеров, создающих направленный пучок монохроматического излучения.
Корунд и его мелкозернистая разновидность, содержащая большое количество примесей, — наждак, применяются как абразивные материалы.
Гидроксид алюминия А1(ОН)3 выпадает в виде студенистого осадка при действии щелочей на растворы солей алюминия и легко образует коллоидные растворы.
Гидроксид алюминия — типичный амфотерный гидроксид. С кислотами он образует соли, содержащие катион алюминия, со щелочами — алюминаты. При взаимодействии гидроксида алюминия с водными растворами щелочей или при растворении металлического алюминия в растворах щелочей образуются, как уже говорилось выше, гидроксоалюминаты, например, Na[Al(OH)4]. При сплавлении же оксида алюминия с соответствующими оксидами или гидроксидами получаются метаалюмин.а-ты — производные метаалюминиевой кислоты НА102) например:
А1203 + 2КОН = 2КАЮ2 + НаО
Как соли алюминия, так и алюминаты в растворах сильно гид-ролизованы. Поэтому соли алюминия и слабых кислот в растворах превращаются в основные соли или подвергаются полному гидролизу. Например, при взаимодействии в растворе какой-либо соли алюминия с Ыа2СОз образуется не карбонат алюминия, а его гидроксид и выделяется диоксид углерода:
2А13+ + 3COJJ- + ЗН20 = 2А1(ОН)з! + ЗС02?
Хлорид алюминия А1С1з- Безводный хлорид алюминия получается при непосредственном взаимодействии хлора с алюминием. Он широко применяется в качестве катализатора при различных органических синтезах. В воде AICI3 растворяется с выделением большого количества теплоты. При выпаривании раствора происходит гидролиз, выделяется хлороводород и получается гидроксид алюминия. Если выпаривание вести в присутствии избытка соляной кислоты, то можно получить кристаллы состава А1С13-6Н20.
Как уже указывалось на стр. 614, химические связи, образуемые атомом алюминия, имеют преимущественно ковалентный характер. Это сказывается на свойствах образуемых им соединений. Так, при нормальном атмосферном давлении безводный хлорид алюминия уже при 180 °С сублимируется, а при высоких давлениях плавится при 193°С, причем в расплавленном состоянии не проводит электрический ток. Поэтому расплав AICI3 нельзя использовать для электролитического получения алюминия.
Сульфат алюминия A^SO^s- 18Н20 получается при действии горячей серной кислоты на оксид алюминия или на каолин. Применяется для очистки воды (см. стр. 598), а также при приготовлении некоторых сортов бумаги.
Алюмокалиевые квасцы КА1 (S04)2-12Н20 применяются в больших количествах для дубления кож, а также в красильном деле в качестве протравы для хлопчатобумажных тканей. В последнем случае действие квасцов основано на том, что образующийся вследствие их гидролиза гидроксид алюминия отлагается в волокнах ткани в мелкодисперсном состоянии и, адсорбируя краситель, прочно удерживает его на волокне.
219. Галлий (Gallium). Иидий (Indium). Таллий (Thallium). Эти элементы принадлежат к числу редких и в сколько-нибудь значительных концентрациях в природе не встречаются. Получают их главным образом из цинковых концентратов после выплавки из них цинка.
В свободном состоянии эти элементы представляют собой серебристо-белые мягкие металлы с низкими температурами плавления. На воздухе они довольно стойки, воду не разлагают, но легко растворяются в кислотах, а галлий и индий — также и в щелочах. Кроме максимальной степени окисленности, равной +3, они могут проявлять и меньшую. В частности, для таллия характерны соединения, где его степень окисленности равна +1.
Оксиды и гидроксиды галлия (III) и индия(III) амфотерны; гидроксид же таллия Т1(ОН)3 обладает только основными свойствами.
Соединения таллия(I) сходны, с одной стороны, с соединениями щелочных металлов, с другой, — с соединениями серебра. Так, оксид таллия (I) Т120 энергично соединяется с водой, образуя гидроксид, отвечающий формуле Т10Н, — сильное, хорошо растворимое в воде основание.
Большинство солей таллия(I) легко растворяется в воде, но соли галогеноводородов, подобно солям серебра, почти нераство-
римы и отличаются светочувствительностью; исключение составляет TIF, который как и AgF, хорошо растворим в воде.
Металлическим галлием пользуются для наполнения кварцевых термометров, служащих для измерения высоких температур. Галлий плавится при 29,8°С, а закипает только при 2205°С, так что такие термометры позволяют измерять температуры до 1000 °С и выше, что невозможно при употреблении обычных термометров. Добавлением галлия к алюминию получают сплавы, хорошо поддающиеся горячей обработке; сплавы галлия с золотом применяются в ювелирном и зубопротезном деле.
Индий используется вместо серебра для покрытия рефлекторов; рефлекторы, покрытые индием, со временем не тускнеют, и поэтому их коэффициент отражения остается постоянным. Индий применяется также для покрытия вкладышей подшипников и в качестве одного из компонентов сплава для плавких предохранителей.
В качестве присадок к германию и в виде интерметаллических соединений с мышьяком и с сурьмой галлий и индий применяются в полупроводниковой электронике.
Таллий и его соединения имеют небольшое по объему, но разнообразное применение. Галогениды таллия хорошо пропускают инфракрасные лучи. Поэтому они используются в оптических приборах, работающих в инфракрасной области спектра. Карбонат таллия служит для изготовления стекол с высокой преломляющей способностью. Таллий входит в состав вещества электрода селенового выпрямителя, является активатором многих люминофоров. Сульфид таллия используется в фотоэлементах. Металлический таллий — компонент многих свинцовых сплавов: подшипниковых, кислотоупорных, легкоплавких.
Таллий и его соединения весьма токсичны.
ПОБОЧНАЯ ПОДГРУППА ТРЕТЬЕЙ ГРУППЫ. ЛАНТАНОИДЫ. АКТИНОИДЫ
Элементы побочной подгруппы третьей группы и семейство, состоящее из четырнадцати /-элементов с порядковыми номерами от 58 до 71, весьма близки друг к другу по своим химическим и физико-химическим свойствам. Эти элементы следуют в периодической системе после лантана и потому называются лантаноидами (или лантан и дам и). Иногда их вместе с элементами побочной подгруппы третьей группы называют редкоземельными металлами.
Редкоземельные металлы обычно находятся в природе совместно. Они образуют минералы, представляющие собой твердые растворы родственных соединений различных металлов. Например, один из главных источников редкоземельных металлов — минерал монацит-—состоит в основном из фосфатов церия, лантана, иттрия и других редкоземельных металлов. Таким образом, природным сырьем, из которого получают как элементы побочной подгруппы третьей группы, так и лантаноиды, служат одни и тс же минералы.
Актиноиды (или а к т и н и д ы) — это семейство четырнадцати /-элементов с порядковыми номерами от 90 до 103, следующее в периодической системе после актиния.
220. Подгруппа скандия. В побочную подгруппу третьей группы входят элементы скандий, иттрий, лантан и актиний. Их атомы содержат по два электрона в наружном электронном слое и по 9 электронов в следующем за ним слое; строение этих двух электронных слоев можно выразить формулой (п — l)s2(n — 1)р6(л—l)(i'ns2. Каждый из этих элементов открывает собой соответствующую декаду d-элементоа. Некоторые их свойства приведены в табл. 36. Степень окисленности элементов подгруппы скандия в большинстве их соединений равна -f-3.
Таблица 36. Некоторые свойства элементов побочной подгруппы третьей группы
| Sc | Y | La | Ac | |
| Строение внешнего и пред- | 3s23pe3d4s2 | 4s24p64[i!l5s2 | .Si'V'Sd'es2 | 6s26p66d'7s2 |
| внешнего электронных | ||||
| слоев атома | ||||
| Радиус атома, нм | 0,164 | 0,181 | 0,187 | 0,203 |
| Энергия ионизации | ||||
| Э-^Э+, эВ | " 6,56 | 6,22 | 5,58 | 5,1 |
| Э+-^Э2+, эВ | 12,8 | 12,24 | 11,06 | 12,1 |
| Э2+-^э3+, эВ | 24,75 | 20,5 | 19,17 | |
| Радиус иона Э34~, им | 0,083 | 0,097 | 0,104 | '6,'lH |
| Плотность, г/см3 | 3,02 | 4,48 | 6,16 | 10,1 |
| Температура плавления, °С | 1040 ±50 | |||
| Температура кипения, °С | Примерно | Примерно | Примерно | Примерно |
Скандий, иттрий и лантан содержатся в земной коре в количествах порядка 10~3 % (масс). Актиний содержится в значительно меньшем количестве [порядка 10~9 % (масс.)], так как оба его природные изотопа — 227Ас и 228Ас — радиоактивны.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 510; Нарушение авторских прав?; Мы поможем в написании вашей работы!