
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Характеристика вагонов 81-717(714) 35 страница
|
|
|
|
| NH, |
NH,
| CI |
Pt
NH,
CI!C1
| Lei |
Pt
NH3
+ СГ
+ NH3
| -NH; -CI |
| [ |
CI NH.-1 Pt NH3 CI J
г CI NH,-. Pt
LCI №1,-1
Кинетические характеристики реакций замещения также служат основанием для оценки транс-влияния лигандов. Лиганды, по их способности ускорять процесс замещения транс-расположенного лиганда, располагаются в ряд CN", С2Н4, СО > N0;. Г, SCN" > Br" > СГ > ОН" > NH3 > Н20.
| * Илья Ильич Черняев (!893—1966), крупный советский химик-неорганик, академик, лауреат Государственных премий, ученик Л. А. Чугаева. Работал в области химии комплексных соединений, главным образом платины и платиновых металлов. В 1926 г. открыл явление транс-влияния, что позволило осуществить направленный синтез целого ряда комплексных соединений, И. И. Черняев — один из организаторов промышленности платины и платиновых металлов в СССР. |
тране-Влняние установлено в основном при изучении комплексов Pt(II), но оно проявляется и в комплексах с центральными ионами Pt(IV), Co(III), Au(III), Pd(II), Rh(I). транс-Влияние является электронным эффектом и связано с изменением электронной плотности. Одна из первых и наиболее наглядных попыток его объяснения была сделана на основе поляризационных представлений: лиганды с большим тране-влияиием имеют легко деформируемую электронную оболочку и являются хорошими восстановителями
(А. А. Гринберг, Б. В. Некрасов). В дальнейшем оказалось, что необходимо также учитывать и способность лиганда к л-акцепторному взаимодействию с центральным атомом.
А. А. Гринбергом и его школой было обнаружено, что кроме транс-влияния имеет место и ^нс-влияние лигандов, хотя этот вид взаимного влияния лигандов обычно проявляется в более слабой форме. Изменение свойств центрального атома и лигандов при комплексообразовании, а также существование транс- и «{«с-влияиия лигандов полностью согласуется с теорией химического строения А. М. Бутлерова, учитывающей все виды взаимного влияния атома и групп атомов в молекулах (см. §§ 38 и 162),
Глава ВТОРАЯ ГРУППА
XIX периодической системы
ГЛАВНАЯ ПОДГРУППА ВТОРОЙ ГРУППЫ
В главную подгруппу II группы входят элементы 6epuAAtiut магний, кальций, стронций, барий и радий. Все эти элементы, кроме бериллия, обладают ярко выраженными металлическими свойствами. В свободном состоянии они представляют собой серебристо-белые вещества, более твердые, чем щелочные металлы, с довольно высокими температурами плавления. По плотности все они, кроме радия, относятся к легким металлам. Их важнейшие свойства приведены в табл. 32.
Первые два члена рассматриваемой подгруппы занимают в ней несколько особое положение, отличаясь во многих отношениях от остальных четырех элементов. Бериллий по некоторым своим свойствам приближается к алюминию («диагональное сходство»—. см. стр. 590).
Все изотопы последнего элемента подгруппы — радия — радиоактивны. Долгоживущий изотоп 226Ra раньше использовался в радиотерапии; в настоящее время его заменили более дешевыми изотопами других элементов, образующимися в ядерных реакторах.
В наружном электронном слое атомы элементов этой подгруппы имеют два электрона, во втором снаружи слое у бериллия находится два электрона, а у остальных элементов — восемь. Два электрона внешнего слоя сравнительно легко отщепляются от? атомов, которые превращаются при этом в положительные двух-зарядные ионы. Поэтому в отношении химической активности эти элементы лишь немного уступают щелочным металлам. Подобно последним, они довольно быстро окисляются на воздухе и могут вытеснять водород из воды при комнатной температуре. Однако бериллий и магний взаимодействуют с водой очень медленно, так как образующиеся при этом гидроксиды малорастворимы в водез покрывая поверхность металла, они затрудняют дальнейшее течение реакции. Остальные четыре металла ввиду лучшей растворимости их гидроксидов реагируют с водой значительно энергичнее»

Входящие в состав главной подгруппы кальций, стронций и барий издавна получили название щелочноземельных металлов. Происхождение этого названия связано с тем, что гидроксиды кальция, стронция и бария, так же, как и гидроксиды натрия и калия, обладают щелочными свойствами, оксиды же этих металлов по их тугоплавкости сходны с оксидами алюминия и тяжелых металлов, носившими прежде общее название земель.
При сжигании щелочноземельных металлов всегда получаются оксиды. Пероксиды, поскольку они вообще образуются, гораздо менее стойки, чем пероксиды щелочных металлов.
Оксиды кальция, стронция и бария непосредственно соединяются с водой, образуя гидроксиды. Растворимость последних сильно увеличивается при переходе от кальция к следующим щелочноземельным металлам. В такой же последовательности увеличиваются и основные свойства гидроксидов.
Щелочноземельные металлы могут соединяться с водородом, образуя гидриды, аналогичные гидридам щелочных металлов (например, СаН2).
Замечательна склонность щелочноземельных металлов соединяться с азотом, возрастающая по мере увеличения их атомной массы. Уже при комнатной температуре щелочноземельные металлы медленно соединяются с азотом, образуя нитриды.
В отличие от солей щелочных металлов, многие из солей щелочноземельных металлов малорастворнмы в воде. К таким солям относятся карбонаты, сульфаты, фосфаты и некоторые другие.
Во всех своих соединениях щелочноземельные металлы имеют степень окисленности -f-2.
209. Бериллий (Beryllium). Бериллий мало распространен в земной коре [0,0004 % (масс.)]. Он входит в состав некоторых минералов, из которых чаще всего встречается берилл Be3Al2(Si03)6. Некоторые разновидности берилла, окрашенные примесями в различные цвета, относятся к драгоценным камням. Таковы, например, зеленые изумруды, голубовато-зеленые аквамарины.
Металлический бериллий получают электролизом расплавов его соединений, главным образом хлорида бериллия. Электролитом служит расплав, содержащий 50 % (масс.) ВеС12 и 50 % (масс.) NaCl; использование расплава такого состава позволяет понизить температуру, при которой проводят электролиз, до 300°С (чистый хлорид бериллия плавится при 440 °С).
Бериллий очень твердый, хрупкий, белый, легкий металл. Он коррозионно стоек вследствие образования на его поверхности оксидной пленки, обладающей защитными свойствами. Вода почти не действует на бериллий; в кислотах же он легко растворяется с выделением водорода.
Для бериллия характерно, что в водных растворах щелочей он тоже растворяется; при этом образуются гидроксоберил-л а т ы:
Be + 2 NaOH + 2Н20 = Na2[Be(OH)4] + H2f
т^трагидроксо-бериллат натрия
Металлический бериллий обладает многими замечательными свойствами. Тонкие пластинки бериллия хорошо пропускают рентгеновские лучи и служат незаменимым материалом для изготовления окошек рентгеновских трубок, через которые лучи выходят наружу. Главной областью применения бериллия являются сплавы, в которые этот металл вводится как легирующая добавка. Кроме бериллиевых бронз (см. § 200), применяются сплавы никеля с 2—4% Be, которые по коррозионной стойкости, прочности и упругости сравнимы с высококачественными нержавеющими сталями, а в некоторых отношениях превосходят их. Они применяются для изготовления пружин и хирургических инструментов. Небольшие добавки бериллия к магниевым сплавам повышают их коррозионную стойкость. Такие сплавы, а также сплавы алюминия с бериллием применяются в авиастроении. Бериллий — один из лучших замедлителей и отражателей нейтронов в высокотемпературных ядерных реакторах. В связи с ценными свойствами бериллия производство его быстро растет.
Как уже указывалось, второй снаружи электронный слой атома бериллия построен иначе, чем у остальных элементов подгруппы: он содержит не восемь, а только два электрона. Поэтому, в сравнении с другими элементами подгруппы (см. табл. 32), радиус атома, а в особенности иона, бериллия непропорционально мал, энергия его ионизации велика, а кристаллическая решетка очень прочна (высокая температура плавления и большая энтальпия атомизации).
Отличие строения атома бериллия от строения атома магния и щелочноземельных элементов сказывается и на свойствах его соединений. Так, Be (ОН) 2 — единственное в подгруппе основание, обладающее амфотерными свойствами (см. ниже). Кроме того, для щелочноземельных металлов и магния характерно образование ионных соединений, тогда как атомы бериллия обычно связаны с атомами других элементов скорее ковалентной связью, чем ионной.
По своим химическим свойствам бериллий в значительной степени сходен с алюминием, находящимся в третьем периоде и в третьей группе периодической системы, т. е. правее и ниже бериллия. Это явление, носящее название диагонального сходства, наблюдается не только у бериллия, но и у некоторых других элементов. Например, бор по многим химическим свойствам сходен с кремнием.
При образовании соединений типа ВеХ2, например ВеС12, атомы бериллия переходят в возбужденное состояние:
| н | Be* | 5s t | t | ||||
При этом за счет распаривания электронов образуются две ковалентные связи и происходит sp-гибридизация: валентные электроны образуют два равноценных sp-гибридных облака, вытянутых в противоположных направлениях. Таким образом, молекулы ВеХ2 имеют линейное строение. Более подробно sp-гибридизация орбиталей в атоме бериллия рассмотрена в § 43; см. также рис. 39 на стр. 130.
Общее число валентных электронов в молекулах, подобных ВеС12, недостаточно для того, чтобы целиком заполнить внешний электронный слой атома бериллия. Поэтому такие молекулы называют эл е к т р о н о д е ф и ц и т н ы м и. Так, в молекуле ВеС12
:С1:Ве:С1:
в наружном слое атома бериллия находятся всего четыре электрона. Поэтому атом бериллия способен быть акцептором элек-
тронных пар и образовывать еще две ковалентные связи по до-иорно-акцепторному способу. В то же время каждый атом хлора, входящий в состав молекулы ВеСЬ, обладает неподеленными электронными парами и может выступать в качестве их донора. Поэтому при охлаждении газообразного хлорида бериллия между отдельными молекулами ВеС12 возникают новые ковалентные связи в соответствии со схемой:
icift:aQ IClQ, • •• Ве^ Be вв
В итоге, при конденсации хлорида бериллия образуются линейные полимерные цепи, в которых атомы хлора играют роль мостиков, связывающих атомы бериллия. Атомы, выполняющие такую функцию, называются мостиков ы ми атомами. Схема строения линейного полимера ВеС12 изображена на рис. 163. Видно, что ковалентность и координационное число бериллия в твердом ВеС12 равны четырем.
Это значение ковалентности и координационного числа характерно для многих устойчивых соединений бериллия. Так, при взаимодействии BeF2 с фторидами щелочных металлов образуются комплексные фторобериллаты, содержащие ион BeF^-, например:
BeF2 + 2KF = K2[BeF4]
тетрафторо-бериллат калия
Здесь атом бериллия находится в состоянии 5р3-гибридизации, благодаря чему ион BeF4_ построен в форме тетраэдра. Тетра-эдрическое расположение атомов бериллия и кислорода характерно и для кристаллического оксида бериллия. В водных растворах ион бериллия, по-видимому, находится также в виде тетра* эдрических аквакомплексов [Ве(Н20)4]2+.
Оксид бериллия ВеО — белое, очень тугоплавкое вещество. Применяется в качестве химически устойчивого огнеупорного материала (в реактивных двигателях, для изготовления тиглей, в электротехнике) и как конструкционный материал в ядерных реакторах.
Гидроксид бериллия Ве(ОН)2 имеет ясно выраженный амфотерный характер, чем резко отличается от гидроксидов
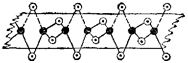 |
Рис. 163. Схема строения линейного полимера (ВеС!2)п:
черные кружки - атомы алюминия, светлые — атомы хлора.
щелочноземельных металлов. В воде он практически нерастворим, но легко растворяется как в кислотах, так и в щелочах, в последнем случае с образованием гидроксобернллатов: Ве(ОН)2 + 2NaOH = Na2[Be(OH)4]
Кислотные свойства гидроксида бериллия выражены очень слабо, поэтому в водном растворе бериллаты сильно гидролизуются.
Большинство солей бериллия, в том числе и сульфат, хорошо растворимы в воде, тогда как сульфаты щелочноземельных металлов в воде практически нерастворимы. В водных растворах ионы Ве2+ подвергаются гидролизу, благодаря чему растворы солей бериллия имеют кислую реакцию.
Все соединения бериллия токсичны. В частности, весьма опасно пребывание в атмосфере, содержащей пыль бериллия или его соединений.
210. Магний (Magnesium). Магний весьма распространен в природе. В больших количествах он встречается в виде карбоната магния, образуя минералы магнезит MgC03 и доломит MgC03-СаС03. Сульфат и хлорид магния входят в состав калийных минералов — каинита КС1 • MgSO; • ЗГЬО и карналлита KCI -MgCb-eHsO. Ион Mg2+ содержится в морской воде, сообщая ей горький вкус. Общее количество магния в земной коре составляет около 2 % (масс).
Магний получают главным образом электролитическим методом. Электролизу подвергают расплавы хлорида магния или обезвоженного карналлита.
Магний — серебристо-белый, очень легкий металл. На воздухе он мало изменяется, так как быстро покрывается тонким слоем оксида, защищающим его от дальнейшего окисления.
Хотя магний стоит в ряду напряжений далеко впереди водорода, но, как мы уже говорили, воду он разлагает очень медленно вследствие образования малорастворимого гидроксида магния. В кислотах магний легко растворяется с выделением водорода. Щелочи на магний не действуют. При нагревании на воздухе магний сгорает, образуя оксид магния MgO и небольшое количество нитрида магния Mg3N2.
Главная область применения металлического магния — это получение на его основе различных легких сплавов. Прибавка к магнию небольших количеств других металлов резко изменяет его механические свойства, сообщая сплаву значительную твердость, прочность и сопротивляемость коррозии. Особенно ценными свойствами обладают сплавы, называемые электронами. Они относятся к трем системам: Mg—Al—Zn, Mg—Мп и Mg—Zn—Zr. Наиболее широкое применение имеют сплавы системы Mg—Al—Zn, содержащие от 3 до 10 % А1 и от 0,2 до 3 % Zn. Достоинством магниевых сплавов является их малая плотность (около 1,8 г/см3). Они используются прежде всего в ракетной технике и в авиастрое-
нии, а также в авто-, мото-, приборостроении. Недостаток сплавов магния — их низкая стойкость против коррозии во влажной атмосфере и в воде, особенно морской.
Чистый магний находит применение в металлургии. Магнийтср-мичееким методом получают некоторые металлы, в частности титан. При производстве некоторых сталей и сплавов цветных металлов магнии используется для удаления из них кислорода и серы. Весьма широко применяется магний в промышленности органического синтеза. С его помощью получают многочисленные вещества, принадлежащие к различным классам органических соединений, а также элементорганнческие соединения. Смеси порошка магния с окислителями употребляются при изготовлении осветительных и зажигательных ракет.
Оксид магния MgO обычно получают путем прокаливания природного магнезита MgCO;i. Он представляет собой белый рыхлый порошок, известный иод названием жженой магнезии. Благодаря высокой температуре плавления (около 3000°С) оксид магния применяется для приготовления огнеупорных тиглей, труб, кирпичей.
Гидроксид магния Mg(OH)2 получается в виде малорастворимого белого осадка при действии щелочей на растворимые соли магния. В отличие от гидроксида бериллия гидроксид магния обладает только основными свойствами, представляя собой основание средней силы.
Сульфат магния MgS04-7H20, или горькая соль, содержится в морской воде. В отличие от сульфатов щелочноземельных металлов, хорошо растворим в воде.
Хлорид магния MgCl2-6H20. Образует бесцветные, хорошо растворимые, расплывающиеся на воздухе кристаллы. Гигроскопичность неочищенной поваренной соли обусловливается примесью к ней незначительных количеств хлорида магния.
Карбонат магния MgC03. Встречается в природе в виде минерала магнезита.
При действий соды на растворимые соли магния получается не средняя соль, а смесь основных карбонатов. Эта смесь применяется в медицине под названием белой магнезии.
Важное промышленное значение имеет хлорид гидроксомагния MgOHCl. Технический продукт получается путем замешивания оксида магния с концентрированным водным раствором хлорида магния и носит название магнезиального цемента. Такая смесь через некоторое время затвердевает, превращаясь в плотную белую, легко полирующуюся массу. Затвердевание можно объяснить тем, что основная соль, первоначально образующаяся согласно уравнению
MgO + MgCl2 + Н20 = 2MgOHCl
затем полимеризуется в цепи типа —Mg—О—Mg—О—Mg—, на концах которых находятся атомы хлора или гидроксилыше группы.
Магнезиальный цемент в качестве вяжущего материала применяется при изготовлении мельничных жерновов, точильных камней, различных нлпт. Смесь его с древесными опилками под названием ксилолита используют для покрытия полов.
Большое применение находят природные силикаты магния: тальк 3MgO-4Si02-H20 и особенно асбест CaO-3MgO-4Si02. Последний, благодаря своей огнестойкости, малой теплопроводности и волокнистой структуре, является прекрасным теплоизоляционным материалом.
Соли магния содержатся в небольшом количестве во всякой почве и необходимы для питания растений, так как магний входит в состав хлорофилла.
211. Кальций (Calcium). Кальций принадлежит к числу самых распространенных в природе элементов. В земной коре его содержится приблизительно 3 % (масс). Он встречается в виде многочисленных отложений известняков и мела, а также мрамора, которые представляют собой природные разновидности карбоната кальция СаСОз. В больших количествах встречаются также гипс CaS04-2H20, фосфорит Са3(Р04)2 и, наконец, различные содержащие кальций силикаты.
Металлический кальций получают, главным образом, электролитическим способом; электролизу обычно подвергают расплав хлорида кальция. Получающийся металл содержит примесь СаС12-Поэтому его переплавляют, а для получения высокочистого кальция перегоняют; оба процесса проводят в вакууме.
Некоторое количество кальция получают алюминотермическим методом. Разработан также способ получения кальция термической диссоциацией карбида кальция СаС2.
Кальций представляет собой ковкий, довольно твердый белый металл. На воздухе он быстро покрывается слоем оксида, а при нагревании сгорает ярким красноватым пламенем. С холодной водой кальций реагирует сравнительно медленно, но из горячей воды быстро вытесняет водород, образуя гидроксид. Кальций — очень активный металл, легко соединяющийся с галогенами, серой, азотом и восстанавливающий при нагревании оксиды многих металлов.
Применение металлического кальция связано с его высокой химической активностью. Он используется для восстановления из соединений некоторых металлов, например, урана, хрома, циркония, цезия, рубидия, для удаления из стали и из некоторых других сплавов кислорода, серы, для обезвоживания органических жидкостей, для поглощения остатков газов в вакуумных приборах. Кроме того, кальций служит легирующим компонентом некоторых свинцовых сплавов.
При нагревании в струе водорода металлический кальций соединяется с водородом, образуя гидрид.
Г ид pud кальция СаН2 — белое солеобразное вещество, бурно реагирующее с водой с выделением водорода: СаН2 + 2Н,0 = Са(ОН)2 + 2Н2Г
Ввиду способности выделять большое количество водорода * гидрид кальция применяется иногда для получения этого газа. Его используют также в качестве эффективного осушителя, способного отнимать воду даже от кристаллогидратов.
Оксид кальция СаО представляет собой белое, очень огнестойкое вещество, плавящееся только при температуре около 2600 °С. В технике оксид кальция называют негашеной, или жженой, известью. Последнее название указывает на способ ее получения —■ накаливание, или «обжигание», карбоната кальция (в виде известняка или мела).
Обжигание производят в высоких, так называемых шахтных печах. Печь загружают чередующимися слоями топлива и известняка и разжигают снизу. При накаливании карбонат кальция разлагается:
СаСОз С02 + СаО — 178 кДж
Поскольку концентрации веществ в твердых фазах постоянны, то для константы равновесия этого процесса получим следующее выражение:
К = [С02]
Концентрацию газа можно выражать его парциальным давлением. Поэтому последнее соотношение означает, что равновесие в рассматриваемой системе устанавливается при определенном парциальном давлении диоксида углерода. Равновесное парциальное давление газа, получающегося при диссоциации вещества, называется давлением диссоциации этого вещества. Давление диссоциации карбоната кальция при различных температурах имеет следующие значения:
Температура, °С 500 600 700 800 900 1000
Давление диссоциации,
кПа 0,015 0,313 3,37 22,4 103,1 361,3
мм рт. ст. 0,11 2,35 25,3 168 773 2710
| * При взаимодействии 1 кг гидрида кальция с водой образуется около 1000 л водорода. |
Для того чтобы нарушить установившееся равновесие и вызвать образование нового количества оксида кальция, нужно или повысить температуру, или удалить часть образовавшегося диоксида углерода, уменьшив тем самым его парциальное давление. Если при некоторой температуре парциальное давление диоксида углерода поддерживается более низким, чем давление диссоциации, то разложение карбоната кальция идет непрерывно. Поэтому при обжигании извести важную роль играет хорошая вентиляция печи, способствующая удалению С02 и позволяющая вести разложение при более низкой температуре.
Если облить жженую известь водой, то вода впитывается пористыми кусками извести и реагирует с ней с выделением значительного количества теплоты. При этом часть воды превращается в пар, а куски извести рассыпаются в рыхлую массу гидроксида кальция:
СаО + Н20 = Са(ОН)2 + 65 кДж
Эта операция носит название гашения извести, а образующийся продукт называется в технике гашеной известью.
Гидроксид кальция Са(ОН)2 — сильное основание, мало растворимое в воде; 1 л воды растворяет при 20 °С всего 1,56 г Са(ОН)2. Насыщенный раствор гидроксида кальция называется известковой водой и имеет щелочную реакцию. На воздухе известковая вода быстро становится мутной вследствие поглощения ею диоксида углерода и образования нерастворимого карбоната кальция.
Гашеную известь широко используют в строительном деле. Смесь ее с песком и водой называется известковым раствором и служит для скрепления кирпичей при кладке стен. Гашеную известь применяют также в качестве штукатурки. Затвердевание извести происходит сначала из-за испарения воды, а затем в результате поглощения гашеной известью диоксида углерода из воздуха и образования карбоната кальция:
Са(ОН)2 + С02 = СаС03 + Н20
Вследствие небольшого содержания С02 в воздухе процесс затвердевания протекает очень медленно, а так как при этом выделяется вода, то в зданиях, построенных с применением известкового раствора, долго держится сырость.
Важнейшие соли кальция были рассмотрены при описании соответствующих кислот.
212. Жесткость природных вод и ее устранение. Ввиду широкой распространенности кальция, соли его почти всегда содержатся в природной воде. Из природных солей кальция только гипс несколько растворим в воде, однако, если вода содержит диоксид углерода, то карбонат кальция тоже может переходить в раствор в виде гидрокарбоната Са(НС03)2.
Природная вода, содержащая в растворе большое количество солей кальция или магния, называется жесткой водой в противоположность мягкой воде, содержащей мало солей кальция и магния или совсем не содержащей их.
Суммарное содержание этих солей в воде называется ее общей жесткостью. Она подразделяется на карбонатную и некарбонатную жесткость. Первая из них обусловлена присутствием гидро-
карбонатов кальция и магния, вторая — присутствием солей сильных кислот — сульфатов или хлоридов кальция и магния. Прн длительном кипячении воды, обладающей карбонатной жесткостью, в ней появляется осадок, состоящий главным образом из СаСОз, и одновременно выделяется С02. Оба эти вещества появляются вследствие разложения гпдрокарбоната кальция:
Са(НС03)2 = СаС03| + C02f + Н20
Поэтому карбонатную жесткость называют также временной жесткостью. Количественно временную жесткость характеризуют содержанием гидрокарбонатов, удаляющихся из воды при ее кипячении в течение часа. Жесткость, остающаяся после такого кипячения, называется постоянной жесткостью.
В СССР жесткость воды выражают суммой миллнэквивалеп-тов ионов кальция и магния, содержащихся в 1 л воды. Один мил-лиэквивалент жесткости отвечает содержанию 20,04 мг/л Са2+ или 12,16 мг/л Mg2+.
Жесткость природных вод изменяется в широких пределах. Она различна в разных водоемах, а в одной и той же реке изменяется в течение года (минимальна во время паводка). В табл. 33 приведены величины жесткости воды некоторых рек СССР в летний период.
Таблица 33. Жесткость воды некоторых рек СССР
| Река | Пункт | Жесткость волы, мэкв'л | ||
| общая | карбонатная | некарбонатиая | ||
| Волга | г. Вольск | 5,9 | 3,5 | 2,4 |
| Днепр | с. Разумовка | 3,7 | 3,2 | 0,5 |
| Дон | ст. Аксакайская | 5,6 | 4,3 | 1,3 |
| Енисей | г. Красноярск | 1.3 | 1.2 | 0,1 |
| Москва | с. Татарово | 4,2 | 4,1 | 0,1 |
| Нева | с. Ивановское | 0,5 | 0,5 |
Жесткость вод морей значительно выше, чем рек и озер. Так, вода Черного моря имеет общую жесткость 65,5 мэкв/л. Среднее значение жесткости воды мирового океана 130,5 мэкв/л (в том числе на Са2+ приходится 22,5 мэкв/л, на Mg2+— 108 мэкв/л).
Присутствие в воде значительного количества солей кальция или магния делает воду непригодной для многих технических целей. Так, при продолжительном питании паровых котлов жесткой водой их стенки постепенно покрываются плотной коркой накипи. Такая корка уже при толщине слоя в 1 мм сильно понижает передачу теплоты стенками котла и, следовательно, ведет к увеличению расхода топлива. Кроме того, она может служить причиной образования вздутий и трещин как в кипятильных трубах, так и на стенках самого котла,
Жесткая вода не дает пены с мылом, так как содержащиеся в мыле растворимые натриевые соли жирных кислот—пальмитиновой и стеариновой — переходят в нерастворимые кальциевые соли тех же кислот:
2C,7H3sCOONa + CaS04 = (С17Н35С00)2Са| + Na2S04
стеарат стеарат
натрия кальция
Жесткой водой нельзя пользоваться при проведении некоторых технологических процессов, например при крашении.
Приведенные выше примеры указывают на необходимость удаления из воды, применяемой для технических целей, солей кальция и магния. Удаление этих солей, называемое водоумягчением, входит в систему водоподготовки — обработки природной воды, используемой для питания паровых котлов и для различных технологических процессов.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 489; Нарушение авторских прав?; Мы поможем в написании вашей работы!