
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Характеристика вагонов 81-717(714) 25 страница
|
|
|
|
Наличие и в альдегидах, и в кетонах карбонильной группы обусловливает определенное сходство six свойств. Однако имеются и различия, связанные с тем, что в молекулах альдегидов одна из связей карбонильной группы затрачивается на соединение с водородом; поэтому они содержат своеобразную альдегидную
функциональную группу —с (или —СН = 0). За счет водо-
\н
рода этой группы альдегиды очень легко окисляются, превращаясь в карбоновые кислоты (см. § 172). Так, при окислении уксусного альдегида образуется уксусная кислота, которую широко используют в промышленности и быту:
^° ^°
2СН3—(Г +02 —> 2СН3—<Г
41 ЧШ
уксусный уксусная
альдегид кислота
Вследствие легкой окисляемости альдегиды являются энергичными восстановителями; этим они существенно отличаются от кетонов, которые окисляются значительно труднее. Например, альдегиды восстанавливают оксид серебра (I) до металлического серебра (реакция серебряного зеркала — серебро осаждается на стенках сосуда, образуя зеркальный налет) и оксид Меди(II) до оксида меди(1) *:
СН3—(Г +Ag20 —СНз—С +2Ag
^° ^°
СНз—С^ +2СиО —> СН3—С^ +Cu20
\Н Ч)Н
Кетоны в этих условиях не окисляются, поэтому обе реакции используют как качественные, позволяющие отличить альдегиды от кетонов.
| * Для этих реакций оксид серебра (I) обычно применяют в форме его бесцветного раствора в водном аммиаке; такой раствор содержит комплексное соединение [Ag(NH3)2]OH. Оксид меди(П) берут в виде щелочного раствора его комплексного соединения с винной кислотой (жидкость Фелинва — синий раствор); оксид меди(1) выпадает в виде красного осадка, при этом си-Ияя окраска реактива исчезает. |
Альдегиды и кетоны можно получать окислением соответствующих спиртов, т. е. имеющих такой же углеродный скелет и гидроксильную группу при том же атоме углерода, который в получаемом альдегиде или кетоне образует карбонильную группу*' Например*
ЗСНз—СН2ОН + К2Сг207 + 4H2S04 —> этиловый спирт
—> ЗСНз-С^ + Сг2(504)з + К2504 + 7Н,0
\Н
уксусный альдегид
5СН3—СН—СН3 + 2КМп04 +3H2S04 —>
изопропиловый спирт
- 5СНз—С—СНз + 2MnS04 + K2S04 + 8H20
диметилкетоц (ацетон)
Муравьиный альдегид, или формальдегид, СН2==0 — газ с рез^ ким неприятным запахом, хорошо растворим в воде. Обладает антисептическими, а также дубящими свойствами. Водный раствор формальдегида (обычно 40%) называется формалином; он широко применяется для дезинфекции, консервирования анатомических препаратов, протравливания семян перед посевом и т. п. Значи* тельные количества формальдегида используются для получения фенолоформальдегидных смол (см. § 177). Получают формальдегид из метилового спирта путем каталитического окисления его кислородом воздуха или путем дегидрирования (отщепления водорода) 5
2СН3—ОН + 02 —> 2СН2=0 + 2Н20 СНз—ОН —> СН2=0 + Н2
Эти реакции протекают при пропускании паров метилового спирта (в первом случае — в смеси с воздухом) над нагретыми катализаторами.
Уксусный альдегид, или ацетальдегид, СН3—СН=0. Легко кипящая бесцветная жидкость (темп. кип. 21 °С), с характерным запахом прелых яблок, хорошо растворима в воде. В промышленности получается присоединением воды к ацетилену в присутствии солей ртути(II) в качестве катализатора!
Hg2+
СН=СН + Н20 ■ > СН3—СН=0
ацетилен уксусный
альдегид
Эта реакция, имеющая большое практическое значение, была открыта М, Г, Кучеровым (1850—1911), Уксусный альдегид затем
может быть окислен в уксусную кислоту; его используют и для многих других синтезов.
Ацетон, или диметилкетон, СН3—СО—СН3. Бесцветная жидкость с характерным запахом (темп. кип. 56,2 °С); смешивается с водой во всех соотношениях. Очень хороший растворитель многих органических веществ. Широко применяется в лакокрасочной промышленности, в производстве некоторых видов искусственного волокна, небьющегося органического стекла, кинопленки, бездымного пороха, для растворения ацетилена (в баллонах).
Ацетон используется также как исходное вещество для синтеза ряда органических соединений.
172. Карбоновые кислоты. Эти соединения характеризуются присутствием в молекулах карбоксильной группы (кар б-
о к с и л а) —с., или упрощенно — СООН, которая является
функциональной (характеристической) группой этого класса соединений. Примерами кислот могут служить:
Н-С(СНз-С^ СНэ-CHj—
Х)Н Х)Н ЮН
муравьиная уксусная Пропионовая
кислота кислота кислота
Из приведенных формул видно, что сложная карбоксильная
группа является сочетанием карбонильной—С^ и гидроксильнои
—ОН групп. Последняя под влиянием карбонильной группы существенно отличается от гидроксильнои группы спиртов, и входящий в нее водород в водных растворах отщепляется в виде катиона; карбоновые кислоты подвергаются электролитической диссоциации, например:
СНз—СООН СНз—COO" + Н*
С основаниями эти кислоты образуют соли:
СНз—СООН + NaOH —> СН3—COONaН20
ацетат натрия (уксуснокислый натрий)
Карбоновые кислоты являются слабыми кислотами, поэтому их соли подвергаются обратимому гидролизу. В зависимости от числа карбоксильных групп в молекуле, карбоновые кислоты подразделяются на одноосновные, двухосновные и т. д.
Карбоновые кислоты, как и неорганические кислоты, со спиртами образуют сложные эфиры (см. § 173), в виде которых часто встречаются в природных продуктах.
Уксусная кислота СНз—СООН (безводная) — жидкость с острым радражающим запахом (темп. кип. 118,1 °С); при +16,7°С застывает в кристаллическую массу, по виду напоминающую лед (100%-ная, или «ледяная» уксусная кислота). Смешивается с водой в любых соотношениях. Широко применяется как приправа к пище и консервирующее средство. В продажу поступает пищевая уксусная кислота в виде 80% (уксусная эссенция) и 9% (уксус) водного раствора. Давно известен натуральный, или винный, уксус — продукт, содержащий уксусную кислоту и получающийся при скисании виноградного вина (в результате микробиологического окисления содержащегося в вине этилового спирта). Уксусная кислота используется также во многих синтезах и как растворитель. Теперь и пищевую и техническую уксусную кислоту получают преимущественно синтезом из ацетилена — присоединением к нему воды по реакции Кучерова и окислением образующегося уксусного альдегида.
Высшие оюирные кислоты. К ним относятся предельные и непредельные карбоновые кислоты с открытой цепью атомов углерода, содержащие 16, 18 и более С-атомов; такого рода кислоты входят в состав природных жиров (см. § 173). Важнейшими являются предельные кислоты пальмитиновая С15Н31СООН, или СНз(СН2)нСООН, и стеариновая С17Н35СООН, или СНз(СНг) 1бСООН, а также непредельная С17Н33СООН, или СНз(СН2)7СН=СН(СН2)7СООН — олеиновая кислота. Высшие предельные кислоты — воскообразные вещества, непредельные — жидкости (напоминающие растительное масло). Натриевые и калиевые соли высших жирных кислот называются мылами (например, Ci7H35COONa — стеарат натрия, С15Н31СООК — паль-митат калия и т. д.). Натриевые мыла — твердые, калиевые—■ жидкие.
Бензойная кислота QH5—СООН, или ^ ^—СООН, простейшая одноосновная кислота ароматического ряда. Бесцветные кристаллы (пластинки) (темп, плавл. 121,5 °С). Антисептик. Применяется для консервирования пищевых продуктов, а также во многих органических синтезах.
Щавелевая кислота НООС—СООН — простейшая двухосновная карбоновая кислота. Кристаллическое вещество (безводная — темп, плавл. 189°С; дигидрат С2Н204-2Н20— темп, плавл. 101,5°С); растворяется в воде; ядовита. В виде кислой калиевой соли содержится во многих растениях. Применяется при крашении тканей.
Терефталевая кислота НООС—С6Н4—СООН. Двухосновная карбоновая кислота ароматического ряда. Ее структурная фор-, мула:
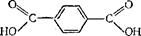
Из терефталевой кислоты и этнленглнколя (см. § 169) получают синтетическое волокно лавсан (см. § 177).
Молочная кислота сн3—СН—СООН может служить примером
I
ОН
соединений со смешанными функциями — проявляет свойства кислоты и спирта (спиртокислота). Она образуется при молочнокислом брожении сахаристых веществ, вызываемом особыми бактериями. Содержится в кислом молоке, рассоле квашеной капусты, силосе.
Салициловая кислота НО—СбН4—СООН — аналог молочной кислоты в ароматическом ряду. Имеет строение:
хон
Относится к соединениям со смешанными функциями — проявляет свойства кислоты и фенола (фенолокислота). Антисептик. Используется (особенно ее соли и эфиры) как лекарственное вещество, а также во многих синтезах.
173. Сложные эфиры карбоновых кислот. Жиры. Продукты взаимодействия карбоновых кислот со спиртами или фенолами представляют собой сложные эфиры. Например:
н-cf + \Н\0— С2Н5 =5=* н—с(+ Н20
Noh" | чос2н6
муравьиная этиловый этиловый эфир
кислота спирт муравьиной
кислоты (этилформиат)
СНз—С' + i Н 10—? J ч=*= СНз—С" /г-л + н2о
уксусная фенол феинловый эфир
кислота уксусной кислоты
(феннлацетат)
Реакция образования сложного эфира из кислоты и спирта (или фенола) называется реакцией этерификации. Она катализируется ионами водорода и поэтому ускоряется в присутствий минеральных кислот.
Сложные эфиры нерастворимы (или почти нерастворимы) в воде, но растворяются в органических растворителях. Растворы их не проводят электрического тока.
Сложные эфиры, в отличие от простых, с большей или меньшей скоростью расщепляются водой —подвергаются гидролизу с образованием вновь кислоты и спирта. Поэтому, как показано в схемах приведенных выше реакций, процесс этерификации обратим и доходит до состояния динамического равновесия. Ионы водорода, как и всякий катализатор (см. § 60), ускоряют протекание не только реакции этернфикации, но и обратной ей реакции гидролиза; таким образом в присутствии минеральной кислоты быстрее достигается равновесие в процессе этернфикации.
Гидролиз сложных эфиров усиливается гидроксид-ионами. При нагревании со щелочами сложные эфиры расщепляются с образованием спирта и соли кислоты;
СН3-СХ + NaOH -—-> СНз—+ С,Н5ОН
этнлозый эфир ацетат натрия
уксусной кислоты (уксуснокислый
(этплацетат) натрии)
Реакция щелочного гидролиза сложных эфиров называется реакцией о м ы л е н и я.
Многие сложные эфиры карбоновых кислот и предельных спиртов имеют приятный запах и часто встречаются в растениях, придавая аромат цветам, запах плодам и ягодам. Некоторые из сложных эфиров готовятся искусственно и под названием «фруктовых эссенций» широко применяются в кондитерском деле, в производстве прохладительных напитков, в парфюмерии. Уксусноизоамило-вый эфир СН3СООС5Н11 (грушевая эссенция) применяется как растворитель целлулоида и других пластмасс.
Жиры. Природные животные и растительные жиры (последние обычно называют маслами) представляют собой смеси сложных эфиров, образованных высшими жирными кислотами (см. § 172)' и трехатомным спиртом глицерином. Приведем схему образования эфира глицерина и стеариновой кислоты:
СН2—О!
СН—О!
Н НО;—СО—С17Н35 СН2—О—СО—Ci7H35
Н + НО |—СО—С17Нз5 —> СН—О—СО—С17Н35+ зн2о
СН2—0|Н НО|—СО—С,7Н35 СН2—О—CO—Ci7H3
В состав твердых жиров входят главным образом эфиры предельных (пальмитиновой и стеариновой) кислот, а в состав жидких растительных масел — эфиры непредельной (олеиновой) кислоты. При действии водорода (в присутствии никеля в качестве катализатора) жидкие жиры превращаются в твердые вследствие присоединения водорода по месту двойной связи между атомами углерода в этерифицированных молекулах непредельной кислоты. Такой процесс называют гидрогенизацией, или отверждением жиров и используют, например, для получения из растительных масел пищевого маргарина.
Как и все сложные эфиры, жиры подвергаются гидролизу (омылению). Гидролиз жиров, сам по себе медленный, катализируется сильными кислотами и ферментами, образующимися в живых организмах. Щелочи также способствуют гидролизу жиров.
При гидролизе жира в нейтральной или кислой среде получаются глицерин и указанные выше кислоты, при гидролизе же в щелочной среде вместо свободных кислот получаются их соли — мыла (см. § 172),
В состав некоторых масел, например льняного масла, входят эфиры глицерина и непредельных высших кислот, в молекулах которых имеется по две и по три двойных связи («высоконепредельные» или «полиненасыщенные» жирные кислоты). Такие масла обладают свойством окисляться на воздухе и, будучи нанесены на какую-нибудь поверхность, образуют твердые и прочные пленки. Они называются высыхающими маслами. Чтобы ускорить процесс высыхания, масла предварительно варят с добавкой сиккативов— оксидов металлов (кобальта, марганца или свинца), являющихся катализаторами в процессе пленкообразования. Таким образом, получают олифу, применяемую для изготовления масляных красок.
Жиры используют для многих технических целей. Однако особенно велико их значение как важнейшей составной части пищевого рациона человека и животных, наряду с углеводами (см, § 174) и белками (см. § 176). Прекращение использования пищевых жиров в технике и замена их непищевыми материалами—• одна из важнейших задач народного хозяйства.
174. Углеводы. К углеводам относятся сахара и вещества, превращающиеся в них при гидролизе. Углеводы — продукты растительного и животного происхождения. Наряду с белками и жирами, они являются важнейшей составной частью пищи человека и животных; многие из них используются как техническое сырье. Углеводы подразделяют на моносахариды, дисахариды и полисахариды.
Моносахариды — простейшие углеводы, они не подвергаются гидролизу — не расщепляются водой на более простые углеводы.
Глюкоза, или виноградный сахар, СеН^Ов — важнейший из моносахаридов; белые кристаллы сладкого вкуса, легко растворяющиеся в воде. Содержится в соке винограда, во многих фруктах, а также в крови животных и человека. Мышечная работа совершается главным образом за счет энергии, выделяющейся при окислении глюкозы.
Глюкоза является шестиатомным альдегидоспиртом; строение ее можно представить формулой (а):

Н Н ОНО
s Is Ц 1з "г 1
ОН ОН К
фруктоза б
Глюкоза получается при гидролизе полисахаридов крахмала и целлюлозы (под действием ферментов или минеральных кислот). Применяется как средство усиленного питания или как лекарственное вещество, при отделке тканей, как восстановитель — в производстве зеркал.
Фруктоза, или плодовый сахар, C6H1206 — моносахарид, спутник глюкозы во многих плодовых и ягодных соках; значительно слаще глюкозы; в смеси с ней входит в состав меда. Представляет собой шестиатомный кетоноспирт; строение фруктозы выражает приведенная выше формула (б).
В формулах глюкозы (а) и фруктозы (б) показано характерное для этих моносахаридов относительное пространственное расположение атомов Н и групп ОН при входящих в углеродную цепь асимметрических (стр. 446) атомах углерода (они помечены звездочками).
Моносахариды как альдегидо- или кетоноспирты являются соединениями со смешанными функциями; природа их усложнена возможностью внутримолекулярных взаимодействий спиртовых гидроксильных групп с альдегидной или кетонной карбонильной группой. Благодаря этому моносахариды существуют и вступают в реакции не только в открытой цепной форме, но еще и в циклических формах. Углеродная цепь моносахарида, например глюкозы (а), может принимать конформацию (стр. 442)' «клешни» (см. ниже формулу в); при этом 1-й С-атом, несущий карбонильную группу, сближается со спиртовой группой при 5-м С-атоме; атом Н из группы ОН перемещается (как показано пунктирной стрелкой) к карбонильному кислороду, а кислород при 5-м С-атоме соединяется с 1-м (карбонильным) С-атомом (это также показано пунктирной стрелкой). В результате замыкается шестичленное, содержащее атом кислорода, кольцо. Так образуются две циклические а- и р-фор мы глюкозы, отличающиеся пространственным расположением атома Н и группы ОН при 1-м (в цикле он становится асимметрическим) С-атоме. Это можно представить перспективными формулами*:
«СН2ОН *СН,0Н «снгон
Н X—о. н I /1» \ I
Н XL—ОН i Н X;— оч он;
9* он" Н ~ <ffон4 н JV
| I I I н он н он |
но \—сг он да Nc—tr il но Nd—к
А он
глюкоза циклическая глюкоза цепная. глюкоза циклическая
| * В перспективных формулах атомы, образующие кольцо, расположены как бы в горизонтальной плоскости, перпендикулярной плоскости чертежа; жирными линиями обозначаются связи между атомами кольца, выдающимися вперед к наблюдателю. |
а-форма карбонильная форма 3-форма

В формулах циклических форм показано (пунктирной стрелкой), что возможен обратный переход атома Н из группы ОН при 1-м С-атоме к кислороду кольца. Последнее при этом раскрывается и образуется цепная форма.
Природная кристаллическая глюкоза (виноградный сахар) представляет собой циклическую а-форму (т. пл. моногидрата 83°С, безводной 146°С). При растворении в воде она, как показано выше на схеме, переходит в цепную, а через нее в р-форму; при этом устанавливается динамическое равновесие между всеми формами *. р-Форма также может быть выделена в кристаллическом виде (т. пл. 148—150 °С); в водном растворе и она образует равновесную систему, содержащую все формы. Цепная же форма существует лишь в растворах, причем в очень небольших количествах (доли процента), а в свободном виде не выделена.
Изомерные формы соединений, способные переходить друг в друга, называют тауто мерными формами, или та у то -м ер а ми, а само существование их — явлением таутоме-р и и; оно весьма распространено среди органических соединений.
Дисахариды — углеводы, которые при нагревании с водой в присутствии минеральных кислот или под влиянием ферментов подвергаются гидролизу, расщепляясь на две молекулы моносахаридов.
| * В равновесной системе моносахаридов образуются и их циклические формы с пятичленным кислородсодержащим кольцом; они неустойчивы и в свободном кристаллическом виде не выделены. Однако известны многие природные и синтетические соединения, являющиеся производными пятичленпых циклических форм моносахаридов (см, в учебниках органической химии). |
Свекловичный, или тростниковый, сахар (сахароза), С12Н22О11— важнейший из дисахаридов. Получается из сахарной свеклы (в ней содержится до 28 % сахарозы от сухого вещества) или из сахарного тростника (откуда и происходят названия); содержится также в соке березы, клена и некоторых фруктов. Сахароза — ценнейший пищевой продукт. При гидролизе она распадается с образованием молекулы глюкозы и молекулы фруктозы (образующаяся смесь этих моносахаридов называется инвертным сахаром):
С12Н22Ои+ Н20 —> С6Н1206 + С6Н1203
сахароза глюкоза фруктоза
Полисахариды. Зти углеводы во многом отличаются от моно- и дисахаридов — не имеют сладкого вкуса, в большинстве нерастворимы в воде; они представляют собой_сложные высокомолекулярные соединения, которые под каталитическим влиянием кислот или ферментов подвергаются гидролизу с образованием более простых полисахаридов, затем дисахаридов и, в конечном итоге, множества (сотен и тысяч) молекул моносахаридов. Важнейшие представители полисахаридов — крахмал и целлюлоза (клетчатка). Их молекулы построены из звеньев —СбНюОв—, являющихся остатками шестичленных циклических форм молекул глюкозы, потерявших молекулу воды; поэтому состав и крахмала, и целлюлозы выражается общей формулой (СбНю05)х. Различие же в свойствах этих полисахаридов обусловлено пространственной изомерией образующих их моносахаридных молекул: крахмал построен из звеньев се-, а целлюлоза — [i-формы глюкозы.
Крахмал (C6Hio05)*— белый (под микроскопом зернистый! порошок, нерастворимый в холодной воде; в горячей — набухает, образуя коллоидный раствор (крахмальный клейстер); с раствором кода дает синее окрашивание (характерная реакция). Молекулы крахмала неоднородны по величине — значение х в них колеблется от сотен до 1000—5000 и более.
Крахмал образуется в результате фотосинтеза в листьях растений, откладывается «про запас» в клубнях, корневищах, зернах. В пищеварительном тракте человека и животных крахмал подвергается гидролизу и превращается в глюкозу, которая усваивается организмом.
В технике превращение крахмала в глюкозу (процесс осахаривания) осуществляется путем кипячения его в течение нескольких часов с разбавленной серной кислотой (каталитическое влияние серной кислоты на осахаривание крахмала было обнаружено в 1811 г. русским ученым К- С. Кирхгофом). Чтобы из полученного раствора удалить серную кислоту, к нему прибавляют мел, образующий с серкой кислотой нерастворимый сульфат кальция. Последний отфильтровывают, и раствор упаривают. Получается густая сладкая масса, так называемая крахмальная патока, содержащая, кроме глюкозы, значительное количество других продуктов гидролиза крахмала. Патока применяется для приготовления кондитерских изделий и для различных технических целей.
Если требуется получить чистую глюкозу, то кипячение крахмала ведут дольше, чем достигается более полное превращение его в глюкозу. Полученный после нейтрализации и фильтрования раствор сгущают, пока из него не начнут выпадать кристаллы глюкозы.
При нагревании сухого крахмала до 200—250 °С происходит частичное разложение его и получается смесь менее сложных, чем крахмал, полисахаридов, называемая декстрином. Декстрин применяется для отделки тканей и изготовления клея. Превращением крахмала в декстрин объясняется образование блестящей корки на печеном хлебе, а также блеск накрахмаленного белья.
Целлюлоза, или клетчатка, (C6Hio05)x — волокнистое вещество, главная составная часть оболочек растительных клеток. Значение х в молекулах целлюлозы обычно составляет около 3000, но может достигать 6000—12 000. Наиболее чистая природная целлюлоза — хлопковое волокно — содержит 85—90 % целлюлозы. В древесине хвойных деревьев целлюлозы содержится около 50 % (в состав древесины наряду с целлюлозой входят ее спутники, среди них важнейшими являются лигнин — природный полимер, построенный из некоторых ароматических кислородсодержащих соединений ряда бензола, и гемицеллюлоза— родственные целлюлозе полисахариды).
Значение целлюлозы очень велико. Достаточно указать, что огромное количество хлопкового волокна идет для выработки хлопчатобумажных тканей. Кз целлюлозы получают бумагу и картон, а путем химической переработки — целый ряд разнообразных продуктов: искусственное волокно, пластические массы, лаки, бездымный порох, этиловый спирт и др.
Наиболее распространенный промышленный способ выделения целлюлозы из древесины заключается в обработке измельченной древесины при повышенных температуре и давлении раствором гидросульфита кальция Ca(HS03)2. При этом древесина разрушается, содержащийся в ней лпгнии переходит в раствор, целлюлоза же остается в неизмененном виде. Затем целлюлозу отделяют от раствора, промывают водой, сушат и направляют на дальнейшую переработку. Целлюлозу, полученную описанным выше способом, часто называют сульфитной целлюлозой.
Целлюлоза не растворяется в воде, диэтиловом эфире и этиловом спирте, она не расщепляется под влиянием разбавленных кислот, устойчива к действию щелочей и слабых окислителей.
При обработке на холоду концентрированной серной кислотой целлюлоза растворяется в ней, образуя вязкий раствор. Если этот раствор вылить в избыток воды, выделяется белый хлопьевидный продукт, так называемый амилоид, представляющий собой частично гидролизованную целлюлозу. Он сходен с крахмалом по реакции с иодом (синее окрашивание; целлюлоза не дает этой реакции). Если непроклеенную бумагу опустить на короткое время в концентрированную серную кислоту и затем сейчас же промыть, то образующийся амилоид склеивает волокна бумаги, делая ее более плотной и прочной, Так изготовляется пергаментная бумага.
При продолжительном действии на целлюлозу концентрированных растворов минеральных кислот она при нагревании подвергается гидролизу, конечным продуктом которого является глюкоза.
В молекулах целлюлозы содержатся спиртовые гидроксильные группы: в каждом остатке глюкозы таких групп три и формулу целлюлозы можно представить так: [С6Н702(ОН)3] х. Поэтому из нее могут быть получены простые и сложные эфиры.
Сложные эфиры целлюлозы и азотной кислоты — нитраты
целлюлозы (нитооцеллюлоза) — могут иметь состав
(C6H702(OHj2(ON02)j„ [C6H?02(OH)(ON02)2]x и
[СбН702(ОЫ02)з] л. Они идут на изготовление бездымного пороха (пироксилина), целлулоида, нитролаков и т. д. Из уксуснокислых эфиров целлюлозы (ацетаты целлюлозы, или ацетилцел-люлоза), например [СбН702(ОСОСН3)з]х, изготовляют негорючую фото- и кинопленку, различные прозрачные пластические массы и лаки.
Большое промышленное значение имеет химическая переработка целлюлозы в искусственное волокно.
Производство искусственного волокна из целлюлозы осуществляется тремя способами: вискозным, ацетатным и медиоаммиачным.
Для получения волокна по вискозному способу целлюлозу обрабатывают едким натром, а затем сероуглеродом. Образующуюся оранжевую массу, называемую ксантогенатом, растворяют в слабом растворе едкого натра, получая так называемую вискозу. Последнюю продавливают через специальные колпачки с мельчайшими отверстиями (фильеры) в осадительиую ванну, содержащую водный раствор серной кислоты. При взаимодействии с серной кислотой щелочь нейтрализуется, и вискоза разлагается, отщепляя сероуглерод и образуя блестящие нити несколько измененной по составу целлюлозы. Эти нити представляют собой вискозное волокно.
При получении по ацетатному способу раствор ацетата целлюлозы в ацетоне продавливается через фильеры навстречу теплому воздуху. Ацетон испаряется и струйки раствора превращаются в тончайшие нити — ацетатное волокно.
Менее распространенным является медноаммиачный способ, при котором используется характерное свойство целлюлозы — ее способность растворяться в аммиачном растворе оксида меди(П) [Cu(NH3)4](OH)2 (реактив Швейцера). Из этого раствора действием кислот вновь выделяют,целлюлозу. Нити волокна получают продавливаиием медиоаммиачного раствора сквозь фильеры в осадительную ванну с раствором кислоты.
175. Амины. Эти органические соединения являются производными аммиака. Их можно рассматривать как продукты замещения одного, двух или всех трех атомов водорода в молекуле аммиака углеводородными радикалами:
Н Н СНз СНз
III I
Н—N: СНз—N: СНз-N: СН3—N:
III I
Н Н Н СН,
аммиак метиламин диметиламин триметиламин
Амины представляют собой органические основания. За счет свободной (неподеленной) пары электронов у атома азота
их молекулы, подобно молекуле аммиака (стр. 124), могут присоединять протоны, отнимая их, например, от молекул воды или кислот. С водой образуются комплексные гидроксиды, а с кислотами— соли замещенного аммония:
Н г Н
| ОН" |
| СН3—N—Н I Н |
| Гидроксид метиламмоиия СН, * |
СНз—N: + Н—О—H I
N
| СНз—N-H |
| СГ |
СН,
СНз—N: + Н—С1 •
!
н
Н J
хлорид диметиламмония
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 494; Нарушение авторских прав?; Мы поможем в написании вашей работы!