
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция №5. Атомные и молекулярные спектры
|
|
|
|
Как было указано в предыдущих лекциях, начальный акт любой фотохимической реакции заключается в поглощении кванта лучистой энергии, в результате чего запас энергии в поглощаемой системе (атоме, молекуле, кристалле и др.) возрастает: Е0 + hν = Е*.
Что же происходит в атомах и молекулах в результате поглощения лучистой энергии?
Любой квантовый переход вещества, заключается в поглощении ли испускании кванта лучистой энергии, определяется основным уравнением частот Бера: hv = hc/l = E¢ - E².
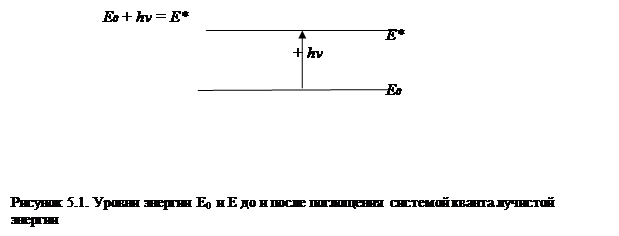 |
Если энергия начального состояния меньше энергии конечного: E¢<E², то молекула или атом поглощают квант лучистой энергии. При обратном соотношении: E¢>E² квант излучается. Таким образом, возникают спектры поглощения или испускания. Каждому квантовому переходу соответствует одна спектральная линия (светящаяся при испускании и темная при поглощении квантов). Атомные спектры имеют линейчатый и относительно простой характер, но поскольку каждый электронный энергетический уровень, характеризуемый квантовым числом – n, может быть расщеплен на подуровни (s, p, d, f), характеризуемыми побочными квантовыми числами – l, спектральные линии могут быть также расщеплены на более узкие, тесно прилегающие линии. Молекулярные спектры значительно сложнее; они наблюдаются в виде более или менее широких полос, распадающихся при достаточной разрешающей силе спектрального прибора на совокупность тесно расположенных линий. Сложность молекулярных спектров по сравнению с атомами обусловлена тем, что молекула, помимо электронных уровней, обладает также дискретными колебательными или вращательными уровнями, отражающими колебательные движения ядер атомов, составляющих молекулу, и энергию вращения молекулы, как в целом, так и в отдельных ее группировках (в случае сложных органических молекул).
Энергетический интервал между электронными уровнями (как в атомах, так и в молекулах) составляет примерно от 250 до 38 ккал/моль, что соответствует длинам волн поглощаемого или излучаемого света (l)- приблизительно от 100 до 750 нм. Колебательные уровни лежат в интервале от нескольких (1-10) ккал/моль до десятых долей ккал/моль, что соответствует l порядка 5-30мкм (ИК-область) разница между вращательными уровнями еще меньше от долей кал/моль до нескольких десятков кал/моль, что соответствует l в далекой ИК-области (порядка 1000-10 000мкм). Очевидно, собственно колебательные или собственно вращательные переходы могут быть вызваны поглощением ИК-излучения и обнаруживаются соответственно в виде ИК-спектров, в то время как к электронным переходам относятся видимая и УФ-области спектра. Поэтому, казалось бы, молекулярные спектры в видимой и УФ-областях должны быть хотя и значительно более сложными, чем атомарные, но все же линейчатыми (соответственно расстояниям между электронными уровнями энергии). В действительности они полосатые, т.е. в определенных интервалах – сплошные (отдельные линии лежат так близко друг к другу, что спектральный прибор не в состоянии их разрешить, т.е. передать раздельно). Это объясняется следующим образом.
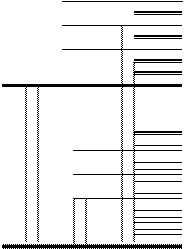
Представим себе простейший случай: 2-х атомную молекулу. На рисунке 5.2 изображены (без соблюдения точного масштаба) электронные, колебательные и вращательные уровни (обозначаемые э, к, в) этой молекулы. Когда молекула находится в “замороженном “ состоянии, т.е. совершенно не обладает энергией возбуждения, в ней отсутствуют колебательные и вращательные движения, и уровень ее энергии определяется некоторым исходным “нулевым” уровнем электронной энергии (линии 0-0). Однако достаточно молекуле поглотить некоторое количество тепловой энергии, чтобы уровень ее энергии поднялся на некоторую большую или меньшую высоту, определяемую соответственно колебательными и вращательными уровнями. Когда мы имеем достаточно большую совокупность молекул, эта совокупность характеризуется некоторым определенным распределением энергий между молекулами, характерным для данных условий.
В результате поглощения лучистой энергии будут иметь место электронные переходы, характеризуемые величинами E¢ +hv =E², причем каждому из них будет соответствовать определенная спектральная линия. Но так как переходы будут совершаться не только с данного основного (например, нулевого) уровня, но с целого ряда близлежащих колебательных и вращательных уровней и будут они завершаться не только на том или ином основном вышележащем электронном уровне (например, на уровне 1), но также на многих других близлежащих колебательных уровнях. Спектральная линия существенно расширится и превратится в спектральную полосу. Понятно, что чем больше и сложнее молекула, тем больше вероятность расширения спектральной полосы и тем больше возможность слияния отдельных полос в сплошной спектр, характерный для данной системы (поэтому конденсированные системы имеют сплошные спектры поглощения).
1 Э 1Э
3 к в
2 к в
1к в
0 0
Рисунок 5.2. Схема электронных, колебательных и вращательных уровней молекулы.
Представим теперь, что лучистая энергия воздействует на какие-то свободные атомы (т.е. атомы, не связанные или очень слабо связанные с другими атомами). Например, пары Hg освещаются УФ-излучением. Атомы Hg поглощают лучи тех длин волн l, которые удовлетворяют условию: l = hc/ E² - E¢.
В случае атома речь может идти о возбуждении только валентных уровней (вращательные и колебательные уровни у свободных атомов отсутствуют), т.е. в уравнении:
l = hc/ E² - E¢, величины E² - E¢ представляют собою разности энергии разрешенных электронных уровней. В результате поглощения соответствующего кванта электрон может перейти на более высокий энергетический уровень – атом будет возбужден А + hv = А*, или, если энергия кванта будет достаточно велика, электрон может быть вырван из атома, т.е. произойдет ионизация атома:
А + hv = А+е-. (В атомном спектре это соответствует коротко-волновой границе линий данной спектральной серии). Время перехода электрона с одного уровня на другой составляет 10-15-10-16с, продолжительность существования возбужденного состояния атома 10-7-10-9 с. Таким образом, хотя время пребывания атома в возбужденном состоянии ~ на 8 порядков больше времени возбуждения, оно все же ничтожно мало; возбужденный атом очень быстро теряет энергию возбуждения и это может произойти двумя разными путями. Если возбужденный атом за указанное время не встретится с каким-то другим атомом и не передаст ему свою избыточную энергию, электрон с более высокого энергетического уровня перейдет на более низкий (рис.5.3) основной или промежуточный уровень. Этот переход (падение электрона на более низкий уровень) будет сопровождаться выпадением кванта лучистой энергии: А* ®А+hv, т.е. будет иметь место явление люминесценции (в зависимости от длительности свечения люминесценция делится на флюоресценцию (10-8- 10-9с) и фосфоресценцию (секунды, минуты, а иногда и часы)). Однако, если возбуждающий атом А* прежде, чем он потеряет избыточную энергию, встретится с каким-то другим атомом или молекулой (М) и передаст им свою избыточную энергию, то атом или молекула, которым была передана энергия возбуждения (М*), могут претерпевать физические или химические превращения:
|
М* - химические или физические превращения. Подобные фотохимические реакции, в которых одно вещество, поглощая лучистую энергию, переходит в возбуждающее состояние, но саму энергию возбуждения не использует, а передает ее другому веществу, которое и претерпевает химическое изменение, называют сенсибилизированными реакциями. Примером такой реакции может служить сенсибилизированный фотолиз водорода. Кванты УФ-излучения с l <300нм несут достаточную энергию, для размещения молекул Н2 на атомы, но облучение газообразного Н2 при l =254нм не вызовет разложение молекул Н2, т.к. они это излучение не поглощают.
   |
Рисунок 5.3. Схема энергетических переходов при поглощении и испускании (люминесценция) кванта лучистой энергии
Однако, если к Н2 добавить немного паров Н2, молекулы Н2 под действием излучения с l =254нм расщепляются на атомы. Процесс идет по следующей схеме:
Hg+hv ® Hg*; Hg*+ Н2 ® Hg+ Н2*; Н2* ® 2Н
Поглощение лучистой энергии молекулами подчиняется тем же закономерностям, что и поглощение атомами. Поскольку молекула значительно более сложная система, определяющаяся рядом дополнительных условий, разрешающих или запрещающих соответствующие электронные переходы.
Для описания электронной структуры молекул в квантовой механике используют метод линейной комбинации атомных орбит (ЛКАО МО). Молекулярная орбиталь, как и атомная, характеризуется набором четырех квантовых чисел n, l, m, s; где n – главное квантовое число – определяет уровень энергии, на котором находится электрон (может принимать значения любого положительного целого числа), l – орбитальное квантовое число определяет форму электронного облака (может принимать значения положительных целых чисел от 0 до n-1 включительно), m – магнитное квантовое число – определяет положение молекулярной орбитали относительно оси молекулы (определяемой проекцией вектора орбитального момента на межъядерную ось в магнитном поле) т.е. определяет ориентацию электронного облака в пространстве. Может принимать значения целых чисел от –l до +l, включая ноль. s - спиновое квантовое число, определяющее собственный момент количества движения электрона, может принимать значения +1/2 и –1/2.
Для определения состояния электрона в многоэлектронном атоме важное значение имеет сформулированное В. Паули положение (принцип Паули), согласно которому в атоме не может быть двух электронов, у которых все 4 квантовых числа были бы одинаковыми. Из этого следует, что каждая атомная орбиталь, характеризующаяся определенными значениями квантовых чисел, может быть занята не более чем двумя электронами, спины которых имеют противоположные знаки.
Молекулярная орбиталь, как и атомная, не может быть занята более чем 2-мя электронами, причем эти 2 электрона должны обладать противоположными спинами.
При образовании простых (двухатомных) молекул из атомных s-орбиталей образуются σ-орбиталь, из р-орбиталей образуется π-орбиталь, из d-орбиталей δ-орбиталь. При комбинировании атомных орбиталей могут образовываться двоякого рода молекулярные орбитали: связывающие и разрыхляющие. В связывающей орбитали электронная плотность между ядрами атомов высока, что вызывает взаимное притяжение двух ядер, таким путем образуется ковалентная химическая связь между атомами. В разрыхляющей орбитали электронная плотность между ядрами понижена или равна нулю, вследствие чего положительно заряженные ядра взаимно отталкиваются. Разрыхляющая орбиталь имеет более высокую энергию, чем связывающая орбиталь, поэтому перевод электрона со связывающей орбитали на разрыхляющую орбиталь требует затраты энергии (другими словами, в этом случае требуется, чтобы молекула получила определенную порцию энергии извне, например, в виде кванта лучистой энергии). Перевод электрона со связывающей орбитали на разрыхляющую орбиталь приводит к разрыву химической связи.
Изучение атомных спектров показывает, что их линии часто имеют тонкую структуру, т.е. расщеплена на 2,3 или более близлежащих линий.
Число линий в тонкой структуре называют мультиплетностью. Мультиплетность отражает число возможных состояний валентных электронов и может быть рассчитана по формуле:
М=2S+1, где S – это суммарный спин атома, равен сумме спиновых квантовых чисел валентных электронов. Если в валентной электронной оболочке атома или молекулы все электроны спарены, то сумма их спиновых квантовых чисел =0. В этом случае М=2*0+1=1, такое состояние атома или молекулы называют синглетным.
Если у атома или молекулы имеется 1 неспаренный электрон, то М=2*1/2+1=2. Такое состояние называют дублетным.
При наличии 2-х неспаренных электронов, спины которых параллельны, мультиплетность М=2(1/2+1/2)+1=3. Такое состояние атома или молекулы называют триплетным. Если в синглетном состоянии атомы или молекулы химически малоактивны, то в дублетном и триплетном состояниях они весьма реакционноспособны.
Синглетное состояние обозначают буквой S, а триплетное – с индексом, указывающим на энергетический уровень, на котором находятся электроны. Например, S0 и T0 - соответственно синглетное и триплетное состояние основного низшего энергетического уровня, S1 и T1 – синглетное и триплетное состояние первого возбужденного уровня и т.п.
Основная литература (5 осн. [165-170])
Контрольные вопросы:
1. Поглощение и излучение лучистой энергии атомами и молекулами.
2. Электронный, колебательный и вращательный уровни энергии.
3. Виды люминесценции
4. Квантовые числа, характеризующие состояние атомов
5. Принцип Паули
6. Понятие мультиплетности
7. Синглетное, дублетное и триплетное состояние.
8. Использование метода молекулярных орбиталей для описания
электронной структуры молекул
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 5583; Нарушение авторских прав?; Мы поможем в написании вашей работы!