
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Константа равновесия окислительно- восстановительной реакции
|
|
|
|
Направление окислительно-восстановительных реакций
Значения стандартных потенциалов позволяют оценить направление реакции. Реакция окисления-восстановления протекает в заданном направлении в том случае, когда разность между стандартными потенциалами редоксипар будет величиной положительной,т.е.
E=E 01 -E0 2>0.
Чем больше разница E01-E02 тем больше вероятность протекания данной реакции.
Пример2. Определите в каком направлении пойдет реакция между Fe3+и иодид-ионом?
Решение: Запишем соответствующие полуреакции и найдем в таблицах значения стандартных потенциалов:
Fe3+ + е D Fe2+ 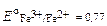 В;
В;
I2 + 2е D2I- 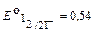 В.
В.
Найдем разность потенциалов:
E=E 01 -E0 2= 0,77В-0,54В=0,23В.
Положительная разность потенциалов указывает на протекание реакции в направлении окисления йодид- иона железом (III).
2Fe3++ 2I- D Fe2+ + I2
О возможности протекания реакций окисления- восстановления можно судить по величине константы равновесия, которая связана со стандартными потенциалами редоксипар уравнением:
lg K = 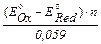 ,
,
где E0Ох и E0Red стандартный потенциал пары, выступающей в данной реакции в качестве окислителя (E0Ох) и в качестве восстановителя(E0Red);
n - число электронов, участвующих в реакции.
Реакция может протекать в прямом направлении, если К>1.Чем больше численное значение К, тем полнее протекает реакция.
Пример3: Рассчитайте константу равновесия реакции:
MnO4-+5Fe2++8H+DMn2+ +5Fe3++ 4H2O
Решение: Находим стандартные окислительно-восстановительные потенциалы и записываем уравнения полуреакций:
MnO4-+5 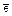 +8H+DMn2+ + 4H2O
+8H+DMn2+ + 4H2O  В
В
Fe2+- 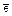 DFe3+
DFe3+ 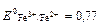 В
В
Число электронов, участвующих в реакции, равно 5. Находим величину К:
lg K =  =62,7
=62,7
К≈ 1063.
Численное значение константы К >>1, значит реакция прошла практически полностью в прямом направлении.
Вопросы для самоконтроля:
1. Что такое окислительно-восстановительная полуреакция?
2. Какие реакции называют окислительно-восстановительными?
3. Что такое стандартный окислительно-восстановительный потенциал?
4. Что такое формальный потенциал? От каких факторов зависит его величина?
5. Напишите уравнение Нернста и пояcните значения входящих в него величин.
6. Как определить направление реакции окисления-восстановления и полноту ее протекания?
7. Запишите уравнение для расчета константы равновесия окислительно-восстановительных реакций и поясните значения входящих в нее величин.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 6314; Нарушение авторских прав?; Мы поможем в написании вашей работы!