
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вычисления при приготовлении растворов
|
|
|
|
Навеску вещества (m) для приготовления определенного объема раствора с заданной молярной концентрацией с (х) или молярной концентрацией эквивалента с(fэкв(х)∙х) можно рассчитать, используя соответствующие формулы:
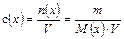 , откуда
, откуда
m= с(х)∙ М(х)∙ V
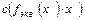
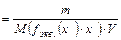 , откуда
, откуда
m=с(fэкв(х)∙х)∙ M(fэкв(х)∙х) ∙V,
где V - вместимость колбы, л;
M(fэкв(х)∙х) - молярная масса эквивалента вещества, г/ моль;
M(fэкв(х)х)= fэкв (х)∙М(х)
где М(х) - молярная масса вещества, г/ моль.
Пример 1. Сколько г Са(ОH)2 необходимо взять для приготовления 150 мл раствора с молярной концентрацией эквивалента 0,2 моль/л? (fжв( Са(ОH)2) =1/2).
Решение: Находим навеску Са(ОH)2 по формуле:
m =с(fэкв(х)∙х)∙ M(fэкв(х)∙х) ∙V
m =0,2∙  ∙74∙0,150=1,11г
∙74∙0,150=1,11г
Пример 2. К раствору серной кислоты объемом 400 мл, плотность которого 1,1 г/см3,а массовая доля H2SO4 15 %, добавили воду массой 60 г. Определите массовую долю серной кислоты в полученном растворе.
Решение:
1. Определяем массу исходного раствора серной кислоты:
mр-ра1 = V р-ра ∙ r р-ра;
mр-ра1 = 400 мл ∙ 1,1 г/мл = 440 г; (1 см3=1 мл)
2. Из формулы массовой доли:
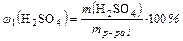
находим массу вещества серной кислоты:
m( H2SO4) = 0,15∙ 440 г = 66 г
3. Масса раствора после прибавления воды:
mр-ра2 = 440 г + 60 г = 500г
4. Находим массовую долю сернoй кислоты в полученном растворе:

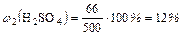
Ответ: 12 %
Пример 3. В воде массой 128 г растворили метиловый спирт объемом 40 мл и плотностью 0,8 г/мл. Определить молярную концентрацию полученного раствора, если его плотность равна 0,97 г/мл.
Решение:
1. Найдем массу метилового спирта
m = V∙p = 40∙0,8=32 г
2. Найдем количество вещества - метилового спирта
n = m/M (CH3OH) = 32/32=1 моль
3. Найдем массу и объем полученного раствора
m(р-ра)= m (CH3OH) + m (H2O) = 32+128=160 г
V= m/p = 160/0.97=165 мл = 0,165 л
4. Молярная концентрация - отношение числа молей растворенного вещества к объему раствора
c( CH3OH) = n/V = 1/0,165=6,06 моль/л
Ответ: 6,06 моль/л
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 1147; Нарушение авторских прав?; Мы поможем в написании вашей работы!