
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способы выражения концентраций
|
|
|
|
Расчеты в титриметрическом анализе
Задачи для самостоятельного решения.
1. Рассчитайте окислительно-восстановительный потенциал для полуреакции:
Fe2+- 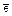 DFe3+ ,
DFe3+ ,
если: [ Fe2+] =0,4 моль/л, [ Fe3+ ] =0,6 моль/л,
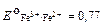 В.
В.
2. Чему равен потенциал пары MnO4-/ Mn2+, если в растворе активности всех ионов равны 1 М.
3. Рассчитайте константу равновесия реакции
2Fe3++Sn2+ D2Fe2++Sn4+.
Ответ: 1021
4. Определите в какую сторону будет направлена реакция, выражаемая уравнением при Т=250С:
2S2O32- + I2 D S4O62- + 2I- ?
5. Рассчитайте константу равновесия реакции при Т=250 С: 2Fe3+ + 2I-D 2F2+ + I2
Ответ:10 8
Титриметрический анализ основан на точном измерении количества реактива, израсходованного на реакцию с определяемым веществом. Титрование – процесс прибавления небольшими порциями стандартного раствора реагента (рабочего раствора, титранта) к анализируемому раствору для определения точно эквивалентного количества. Момент титрования, когда количество добавленного титранта химически эквивалентно количеству титруемого вещества, называется точкой эквивалентности (т.э.).
Если определяемое вещество А реагирует с раствором титранта В по уравнению
а A+ b В = продукты реакции
где a и b- стехиометрические коэффициенты,
то данную реакцию можно записать также в виде
А+  B= продукты реакции
B= продукты реакции
Одна частица вещества А будет эквивалентна  частицы вещества В.
частицы вещества В.
Отношение  обозначают символом f экв.(B) и называют фактором эквивалентности вещества В. Фактор эквивалентности является безразмерной величиной, равной или меньше единицы.
обозначают символом f экв.(B) и называют фактором эквивалентности вещества В. Фактор эквивалентности является безразмерной величиной, равной или меньше единицы.
Величину fэк в.(B) называют эквивалентом или эквивалентной формой В.
Эквивалентом называют реальную или условную частицу вещества Х, которая в данной кислотно-основной реакции эквивалентна одному иону водорода или в данной реакции окисления –восстановления –одному электрону.
|
|
|
Фактор эквивалентности- число, обозначающее, какая доля реальной частицы вещества Х эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной реакции окисления-восстановления. Например, в реакции
NaOH+  Н2 SO4=
Н2 SO4=  Na2 SO4+H2O
Na2 SO4+H2O
fэкв . (NaOH)=1; fэкв . (Н2 SO4)= 
Эквивалент серной кислоты в этой реакции будет
fэкв . (Н2 SO4) Н2 SO4 =  Н2 SO4.
Н2 SO4.
Эквивалент и фактор эквивалентности зависят от того, в какой реакции данное вещество участвует.
Для реакции
Н3РО4+КОН=КН2РО4+Н2О (a)
fэкв . (Н3РО4 )=1; fэкв . (Н3РО4 ) Н3РО4= Н3РО4 ,
а для реакции
Н3РО4+2КОН=К2НРО4+2Н2О (b)
fэкв . (Н3РО4 )=  ; fэкв . (Н3РО4 ) Н3РО4=
; fэкв . (Н3РО4 ) Н3РО4=  Н3РО4.
Н3РО4.
В реакции (а) эквивалентом фосфорной кислоты является Н3РО4,а в реакции (б)- условная частица  Н3РО4.
Н3РО4.
В полуреакции:
MnO4-+5 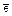 +8H+DMn2+ + 4H2O
+8H+DMn2+ + 4H2O
участвуют 5 электронов, следовательно, фактор эквивалентности перманганата fэкв . (КMnO4 ) = 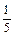 .
.
Эквивалентом перманганата является условная частица 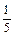 КMnO4:
КMnO4:
fэкв . (КMnO4 ) КMnO4= 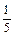 КMnO4.
КMnO4.
Фактор эквивалентности и эквивалент данного вещества являются не постоянными величинами, а зависят от стехиометрии реакции, в которой принимают участие.
Молярной массой эквивалента вещества Х называют массу одного моля эквивалента этого вещества, равную произведению фактора эквивалентности на молярную массу вещества Х.
M(fэкв(х)х)= fэкв (х)∙М(х)
Отношение количества вещества эквивалента в растворе к объему раствора называют молярной концентрацией эквивалента:
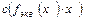

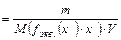
Молярную концентрацию эквивалента обозначают латинской буквой «с» с указанием эквивалента (обычно в скобках), например,
с (1/5 К MnO4)=0,05моль- экв/л.
Наряду с молярной концентрацией эквивалента в титриметрическом анализе используют и другие способы выражения концентрации раствора.
Молярная концентрация с (х) вещества х в растворе - это количество растворенного вещества п (х) (в молях), деленное на объем раствора V(в литрах):
|
|
|
 ,
,
где М(х) - молярная масса вещества, г/моль;
m- масса данного вещества, г.
Вместо обозначения размерности молярной концентрации «моль/л» допускается обозначение «М». Например: C (НСl)=0,1 M
Титр (Т) – масса вещества, содержащаяся в одном миллилитре раствора. Размерность – г/мл.
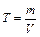
Титр раствора можно выразить по рабочему веществу и по определяемому веществу. Титр раствора по рабочему веществу (Тх) показывает, сколько граммов рабочего вещества содержится в 1 мл раствора. Например, Т (HCl)=0,0002510 г/мл, значит в 1 мл такого раствора содержится 0,0002510 г HСl. Титр связан с молярной концентрацией эквивалента формулой:
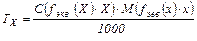
где M(fэкв (х)∙х) - молярная масса эквивалента, г/ моль. Титр по определяемому веществу (ТR/Х) показывает, сколько граммов определяемого вещества Х реагирует с 1 мл рабочего раствора R. Титр по определяемому веществу связан с молярной концентрацией эквивалента формулой:
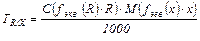
где C (f экв (R)∙R)- молярная концентрация эквивалента рабочего раствора, моль/л;
M(fэкв (х)∙х) - молярная масса эквивалента определяемого вещества, г/ моль.
Массовая доля w(X) вещества Х в растворе - это масса растворенного вещества m(Х), деленная на общую массу раствора mобщ:
 или
или
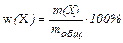
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 606; Нарушение авторских прав?; Мы поможем в написании вашей работы!