
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные формулы
|
|
|
|
МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА.
Количество вещества тела (системы) 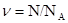 ,
,
где N – число структурных элементов (молекул, атомов, ионов и т. п.), составляющих тело (систему); 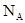 - постоянная Авогадро (
- постоянная Авогадро ( ).
).
Молярная масса вещества  ,
,
где m – масса однородного тела (системы);  - количество вещества этого тела.
- количество вещества этого тела.
Относительная молекулярная масса вещества
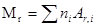 ,
,
где 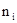 - число атомов i -го химического элемента, входящих в состав молекулы данного вещества;
- число атомов i -го химического элемента, входящих в состав молекулы данного вещества; 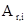 - относительная атомная масса этого элемента. Относительные атомные массы приводятся в таблице Д. И. Менделеева. См. также табл. 9 Приложения.
- относительная атомная масса этого элемента. Относительные атомные массы приводятся в таблице Д. И. Менделеева. См. также табл. 9 Приложения.
Связь молярной массы М с относительной молекулярной массой вещества
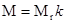 ,
,
где  кг/моль. Количество вещества смеси газов
кг/моль. Количество вещества смеси газов
 ,
,
или 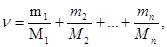
где  - соответственно количество вещества, число молекул, масса, молярная масса i -го компонента смеси.
- соответственно количество вещества, число молекул, масса, молярная масса i -го компонента смеси.
Уравнение Менделеева – Клапейрона (уравнение состояния идеального газа)
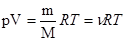
где m – масса газа, М – молярная масса газа, R – молярная газовая постоянная,
 - количество вещества, Т – термодинамическая температура.
- количество вещества, Т – термодинамическая температура.
Опытные газовые законы, являющиеся частными случаями Менделеева – Клапейрона для изопроцессов:
а) закон Бойля – Мариотта (изотермический процесс: Т = const, m=c onst)  = const,
= const,
или для двух состояний газа 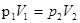 ;
;
б) закон Гей – Люссака (изобарный процесс: p = const, m = const)
 = const,
= const,
или для двух состояний 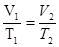 ;
;
в) закон Шарля (изохорный процесс: V = const, m = const)
 = const,
= const,
или для двух состояний 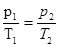 ;
;
г) объединенный газовый закон (m = const)
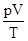 =const, или
=const, или 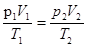
где  - давление, объем, и температура газа в начальном состоянии;
- давление, объем, и температура газа в начальном состоянии; 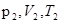 - те же величины в конечном состоянии.
- те же величины в конечном состоянии.
Закон Дальтона, определяющий давление смеси газов,
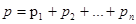 ,
,
где  - парциальные давления компонентов смеси; n – число компонентов смеси.
- парциальные давления компонентов смеси; n – число компонентов смеси.
Парциальным давлением называется давление газа, которое производил бы этот газ, если бы только он один находился в сосуде, занятом смесью.
Молярная масса смеси газов  ,
,
где 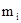 - масса i -го компонента смеси;
- масса i -го компонента смеси; 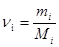 - количество вещества i -го компонента смеси; n – число компонентов смеси.
- количество вещества i -го компонента смеси; n – число компонентов смеси.
Массовая доля i -го компонента смеси газа (в долях единицы или процентах) 
где m – масса смеси.
Концентрация молекул 
где N – число молекул, содержащихся в данной системе;  - плотность вещества; V – объем системы. Формула справедлива не только для газов, но и для любого агрегатного состояния вещества.
- плотность вещества; V – объем системы. Формула справедлива не только для газов, но и для любого агрегатного состояния вещества.
Основное уравнение кинетической теории газов  ,
,
где  - средняя кинетическая энергия поступательного движения молекулы.
- средняя кинетическая энергия поступательного движения молекулы.
Средняя кинетическая энергия поступательного движения молекулы
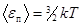 ,
,
где  - постоянная Больцмана.
- постоянная Больцмана.
Средняя полная кинетическая энергия молекулы 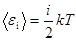 ,
,
где i – число степеней свободы молекулы.
Зависимость давления газа от концентрации молекул и температуры
 .
.
Скорости молекул:
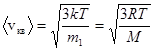 - средняя квадратичная;
- средняя квадратичная;
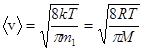 - средняя арифметическая;
- средняя арифметическая;
 - наиболее вероятная,
- наиболее вероятная,
где 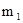 - масса одной молекулы.
- масса одной молекулы.
Относительная скорость молекулы 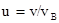 ,
,
где v - скорость данной молекулы.
Средняя длина свободного пробега молекулы 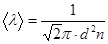 ,
,
где d -эффективный диаметр молекулы.
Среднее число столкновений молекулы в единицу времени
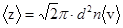 .
.
Уравнение диффузии 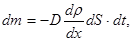
где D - коэффициент диффузии, r - плотность, dr/dx - градиент плотности,
dS - элементарная площадка, перпендикулярная оси Оx, dt - время.
Уравнение теплопроводности 
где k - коэффициент теплопроводности, dT/dx - градиент температуры, dt - время.
Сила внутреннего трения 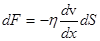 ,
,
где h - коэффициент динамической вязкости, dv/dx - градиент скорости, dS - элемент площади.
Коэффициент диффузии  .
.
Коэффициент динамической вязкости 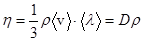 .
.
Коэффициент теплопроводности 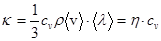 ,
,
где cV - удельная теплоемкость при постоянном объеме.
Удельные теплоемкости газа при постоянном объеме  и постоянном давлении
и постоянном давлении 
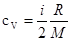 ,
,  .
.
Связь между удельной с и молярной С теплоемкостями
 .
.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 642; Нарушение авторских прав?; Мы поможем в написании вашей работы!