
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сетчатка 2 страница
|
|
|
|
Рис. 3.6.34. Особенности строения ганглиозных клеток
сетчатки человека, определяющих функционирование
Р- и М-трактов зрительного анализатора:
/ — карликовая Р1; 2 — маленькая зонтикоподобная Р2; 3 — большая зонтикоподобная М
М-клетки проецируются на магноцеллюляр-ные (крупноклеточные) слои наружного коленчатого тела и определяют так называемый «не-оппонентный» ответ (см. главу 4). По своим
Глава 3. СТРОЕНИЕ ГЛАЗНОГО ЯБЛОКА
 физиологическим характеристикам, М-клетки человека напоминают ганглиозные клетки обезьяны, специализированные на восприятии цвета.
физиологическим характеристикам, М-клетки человека напоминают ганглиозные клетки обезьяны, специализированные на восприятии цвета.
Р-клетки проецируются на парвоцеллюляр-ные (мелкоклеточные) слои наружного коленчатого тела. Клетки типа Р1 самые маленькие и обладают небольшим дендритным деревом.
Эти клетки определяют «оппонентный» ответ при стимуляции сетчатки средне- и коротковолновой частями спектра. Каждая Р-клетка получает информацию только от одной колбочки. Ганглиозные клетки типа Р1 подразделяют на так называемые широковетвистые (а-тип) и слабоветвистые (b-тип). Первые участвуют в формировании рецептивных полей с OFF-цент-рами, а вторые — с ON-центрами.
В области центральной ямки клетки типа Р1 составляют 90% общего количества ганглиозных клеток. В этой области сетчатки их удлиненные тела имеют размеры 8x12 мкм и достигают максимума (14x16 мкм) на расстоянии 8 мм от фовеа. Здесь они составляют 40—45% от общего количества ганглиозных клеток [227].
Единственный дендрит клетки формирует небольшое количество терминалов (5—7 нм в диаметре). Они переходят во внешнюю (а-тип) или внутреннюю (b-тип) треть внутреннего плексиформного слоя сетчатки [225, 595]. Синапсы а-типа образуются между аксонами плоских диффузных биполярных клеток, а синапсы b-типа — с инвагинирующими биполярными клетками.
В терминалах типа «диад» или «монад» присутствует до 55—81 лент. Количество отростков амакриновых клеток, которые образуют синапсы с дендритическим деревом этих ганглиозных клеток, приблизительно равно числу синап-тических лент биполярной клетки [595]. Распространяются дендриты ганглиозных клеток типа Р1 на 5—10 мкм в центральных областях сетчатки, а по периферии на 225 мкм [225, 592].
Отличить ганглиозные клетки Р1 от Р2 в области центральной ямки практически невозможно. Однако в 1,5 мм от нее клетки типа Р2 значительно больших размеров. Дендритное поле клеток, расположенных на расстоянии 6—8 мм от центральной ямки простирается на 30—50 мкм, а лежащих по периферии сетчатки на 400 мкм [225].
Клетки типа Р2 проявляют выраженный ответ при стимуляции светом S-колбочек [229]. Они составляют 1 % общего количества ганглиозных клеток в области фовеа и 10% по периферии сетчатой оболочки [227].
Размер М-ганглиозных клеток больше, чем клеток типа Р. Больше и их дендритные поля (25—30 мкм). Причем дендритное поле увеличивается по мере продвижения к периферии сетчатки. Так, в 8 мм от центральной ямки дендритное поле равняется 160 мкм, а на расстоянии 14 мм — 270 мкм [231].
М-клетки составляет 5% общего количества ганглиозных клеток в области центральной ямки и 20% по периферии сетчатки [227].
В литературе сейчас активно обсуждается вопрос о гибели ганглиозных нейронов сетчатки при глаукоматозном процессе, именуемом как глаукоматозная нейропатия. Само это состояние рассматривается как многолетний хронический процесс с постепенной медленной потерей отдельных ганглиозных клеток или их небольших групп при сохранении морфологии и функции других. Предполагалось, что в этом процессе преимущественно погибают магноцел-люлярные М-нейроны [851]. Однако Morgan et al. (2000) обнаружили, что в сетчатке обезьян с экспериментальной гипертензией в одинаковом соотношении погибают и магно- и парвоцеллю-лярные нейроны. При этом клетки сморщиваются, так что объем М-нейронов достоверно уменьшается на 20%, а Р-нейронов — на 16%.
Слой нервных волокон (рис. 3.6.1, см. цв. вкл.). Слой нервных волокон образуется аксонами ганглиозных клеток (так называемые «центростремительные», или «приводящие» волокна), а также глиальными элементами, большим количеством капиллярных сосудов и цент-рифугальных (эфферентных) волокон.
Аксоны ганглиозных клеток образуют дуги, очерченные отростками мюллеровских и других глиальных клеток. Отдельные афферентные волокна имеют диаметр от 0,6 мкм до 2,0 мкм. Они содержат микротрубочки, митохондрии и гладкую эндоплазматическую сеть. В них происходит двухсторонний аксоплазматический поток двух типов — медленный и быстрый. Медленный поток (0,5—5 лш/день) несет высокомолекулярные белки, используемые для роста аксонов и их физиологической регенерации. Быстрый поток (10—2000 лш/день) обеспечивает функционирование синапсов путем поставки питательных веществ [305, 722, 796].
Механизмы, обеспечивающие аксонный транспорт, изучаются до сих пор. В соответствии с одной из теорий движение в направлении аксона обеспечивается движением цитоплазмы [796]. Другие авторы считают, что в этом процессе основную роль играют микротрубочки. В подтверждение правильности последнего предположения приводится факт прекращения транспорта после обработки клеток колхицином, разрушающим микротрубочки [276].
Аксоны ганглиозных клеток сетчатки остаются немиелинизированными до момента достижения ими решетчатой пластинки.
Аффрентные волокна радиально продвигаются параллельно внутренней пограничной мембране и сходятся в области диска зрительного нерва. Исключением являются аксоны, исходящие из ганглиозных клеток, расположенных непосредственно с височной стороны диска зрительного нерва. Волокна папилло-макулярного пучка распространяются дугообразно. Верхние
Сетчатка
 и нижние волокна отделены горизонтальным «швом», простирающимся от желтого пятна до крайней периферии сетчатки.
и нижние волокна отделены горизонтальным «швом», простирающимся от желтого пятна до крайней периферии сетчатки.
Наиболее толстым является слой нервных волокон у края диска зрительного нерва с назальной стороны (20—30 мкм). Толщина его уменьшается по мере приближения к зубчатой линии. Значительно точнее варианты изменения толщины слоя нервных волокон можно выявить при помощи лазерной офтальмоскопии [830]. Эти данные важны при установлении диагноза ряда заболеваний глаза, в частности глаукомы.
Папилло-макулярный пучок является наиболее тонкой частью слоя нервных волокон, расположенного вокруг диска зрительного нерва. Поскольку наибольшее количество аксонов собирается с назальной стороны диска зрительного нерва, они образуют возвышенность (сосок), выстоящую в стекловидное тело.
Центрифугальные волокна, берущие свое начало в центральной нервной системе, заканчиваются во внутреннем плексиформном слое или самой внутренней части внутреннего ядерного слоя. Обычно они образуют синапс с амакри-новыми клетками или стенками капиллярных сосудов. В последнем случае эти волокна обеспечивают вазомоторные функции и регулируют интенсивность кровообращения.
Внутренняя пограничная мембрана. Внутренняя пограничная мембрана образует самый внутренний слой сетчатки и располагается на границе со стекловидным телом. Она является единственной истинной мембраной сетчатки. В образовании внутренней пограничной мембраны участвует как сетчатка, так и стекловидное тело. Состоит мембрана из четырех элементов: 1) коллагеновые волокна и 2) протео-гликаны (главным образом, гиалуроновая кислота) стекловидного тела; 3) базальная мембрана; 4) плазматическая мембрана мюллеровских клеток, возможно, и других глиальных клеток сетчатки.
Базальная мембрана положительно окрашивается при проведении ШИК-реакции.
Электронномикроскопически установлено, что коллагеновые волокна стекловидного тела, погруженные в протеогликаны, вплетаются в базальную мембрану глиальных клеток.
В задних отделах сетчатки внутренняя пограничная мембрана достигает толщины 0,5— 2,0 мкм. Она продолжается непрерывным слоем до желтого пятна, где значительно утолщается [473]. Отсутствует она по краю диска зрительного нерва, переходя в базальную мембрану астроцитов зрительного нерва [67]. По периферии сетчатки мембрана переходит в базальную пластинку эпителия ресничного тела. При старении внутренняя пограничная мембрана утолщается и прерывается в области зубчатой линии.
Внутренняя часть внутренней пограничной мембраны называется еще стекловидной мемб-
раной стекловидного тела. Именно она и придает поверхности сетчатки характерный блеск, наблюдаемый при офтальмосокопии. Обычно стекловидное тело плотно прилежит к сетчатке у диска зрительного нерва, в области центральной ямки и у зубчатой линии.
3.6.3. Зрительные пигменты и фоторецепция
Описывая строение сетчатой оболочки, необходимо хотя бы кратко остановиться на процессах, происходящих в фотороцепторах и определяющих понятие фоторецепции.
Процесс восприятия света связан непосредственно с физико-химическими процессами, происходящими в стопках мембран наружных члеников палочек и колбочек, и представляет собой целую систему связанных между собой химических преобразований, направленных на трансформацию световой энергии в нервный импульс. В систему этих преобразований входят также механизмы, направленные на восстановление веществ, обеспечивающих световос-приятие, регенерацию наружных члеников фо-торецепторых клеток и др. Центральное место в восприятии световой энергии занимают специализированные вещества — зрительные пигменты, которые располагаются именно в мембранах наружных члеников фоторецепторных клеток.
Сейчас мы кратко остановимся на сути происходящих при световосприятии процессах. Первоначально мы опишем особенности химической организации мембран наружных члеников фотороцепторов и зрительных пигментов.
Как было указано выше, мембраны наружных сегментов палочек и колбочек содержат зрительные пигменты, которые абсорбируют световую энергию и инициализируют зрительное возбуждение. Эти белковые молекулы внедрены в двухслойные липидные мембраны пластин наружных члеников фоторецепторов (рис. 3.6.35, см. цв. вкл.). В наружных сегментах палочек липиды и белки составляют примерно 50% веса. Большинство липидов относятся к фосфолипидам. В состав фосфолипи-дов, помимо глицерина, входят также две цепи жирной кислоты (в положении 1 и 2) и фосфорнокислая группа (в положении 3). В липидном слое мембраны цепи жирных кислот ориентированы таким образом, что внутри мембраны образуется гидрофобная область, а снаружи располагаются глицерол/фосфатные группы, обеспечивающие гидрофильность этой поверхности мембраны. Характерной особенностью липидов сетчатки является высокое их насыщение ненасыщенными жирными кислотами.
Наружные сегменты палочек содержат также большое количество различных белков, главным из которых является опсин. Родопсин представляет собой соединение 11-цис-ретина-
Глава 3. СТРОЕНИЕ ГЛАЗНОГО ЯБЛОКА
 ля (альдегид витамина А) с опсином посредством основания Шиффа. Родопсин относится к так называемым трансмембранным белкам, N-конец которых обращен в междисковое пространство, а С-конец обращен в цитоплазму (рис. 3.6.35) [447, 448]. Благодаря этому молекулы хромофора ориентированы параллельными рядами вдоль мембран наружных члеников фоторецепторов, т. е. располагаются перпендикулярно падающим на него фотонам, обеспечивая максимальный сбор световой информации. Установлено, что диск наружного сегмента палочки содержит от 300 до 900 молекул родопсина [447, 448].
ля (альдегид витамина А) с опсином посредством основания Шиффа. Родопсин относится к так называемым трансмембранным белкам, N-конец которых обращен в междисковое пространство, а С-конец обращен в цитоплазму (рис. 3.6.35) [447, 448]. Благодаря этому молекулы хромофора ориентированы параллельными рядами вдоль мембран наружных члеников фоторецепторов, т. е. располагаются перпендикулярно падающим на него фотонам, обеспечивая максимальный сбор световой информации. Установлено, что диск наружного сегмента палочки содержит от 300 до 900 молекул родопсина [447, 448].
В сетчатке человека выявлено четыре типа зрительных пигментов. Один тип обнаружен в палочках (родопсин) и три в колбочках (иодо-псин). В зависимости от спектральных особенностей поглощения световой энергии колбочко-вые пигменты разделяются на чувствительные к красной (570 нм), зеленой (540 нм) и синей частям спектра (440 нм). 11-цис-ретиналь является хромофором для всех четырех классов зрительных пигментов человека.
Основным механизмом преобразования световой энергии является изменение характера взаимодействия хромофора (11-цис-ретиналь) с белком (опсин). Механизм этого процесса сводится к тому, что при действии световой энергии происходит изомеризация 11-цис-ретиналя с превращением его в полностью транс-рети-наль (рис. 3.6.36). Изменение строения молекулы ретиналя разрушает ее связь с опсином, что приводит к нарушению третичной структуры белка. Этот процесс происходит через ряд звеньев с образованием промежуточных продуктов. Эти промежуточные вещества существуют
| 11 -цис-ретинил эфир |

|
| 11-цис-ретинол |
| ПЭС |
 Полностью-транс-ре-тинил эфир
Полностью-транс-ре-тинил эфир
| 11-цис ретинол__ НАдф НАДФН + Н+- |

|
| X та О ч |
| Полностью-транс-ретиналь 1 Опсин |


 Полностью-транс-ретинол
Полностью-транс-ретинол
11-цис ретиналь
Родопсин
| JI |

 НСП
НСП
Рис. 3.6.36. Химические превращения родопсина в процессе зрительного цикла:
ПЭС — пигментный эпителий сетчатки; НСП — наружный сегмент палочки
исключительно короткое время и их можно анализировать только при низких температурах (рис. 3.6.37). Наиболее важным звеном в этом процессе является переход метародопсина I в метародопсин II. Именно на этом этапе и происходят конформационные изменения белковой части родопсина, что приводит к появлению у последнего ферментативной активности. Эти изменения инициируют дальнейший каскад процессов преобразования, о которых речь пойдет несколько ниже [78, 371, 448].
Родопсин (498 нм)
Свет ------ *- I Пикосекунды
Прелюмиродопсин (батородопсин) (543 нм)
I Наносекунды
Люмиродопсин (497 нм)
I Микросекунды
Метародопсин I (478 нм)
I Миллисекунды
Метародопсин II (380 нм)
I Секунды
Метародопсин III (465 нм)
I Минуты
Опсин (280 нм)
+ Транс-ретиналь (380 нм)
Рис. 3.6.37. Схема превращений родопсина под действием световой энергии (в скобках указаны спектральные изменения продуктов реакции)
После разрушения связи хромофора с опсином наступает обратный процесс, т. е. регенерация родопсина. Происходит это следующим образом (рис. 3.6.36). При обесцвечивании зрительного пигмента полностью-транс-ре-тиналь высвобождается из зрительного пигмента и преобразуется в полностью-транс-ретинол. Полностью-транс-ретинол из наружных сегментов фоторецепторов поступает в пигментный эпителий сетчатки, где он эстерифицируется, превращаясь в эфир полностью-транс-ретинил эфир. Последний превращается в 11-цис-ретинол благодаря деятельности фермента — рети-ноид изомеразы. Образовавшийся в результате реакции 11-цис-ретонол возвращается в фоторецепторы, где, окисляясь, превращается в 11-цис-ретиналь. 11-цис-ретиналь соединяется с опсином, образуя родопсин. Вновь образованный родопсин может опять абсорбировать
Сетчатка

|

|
| Темновые условия Наружный сегмент Внутренний сегмент |
| 3Na* |
| -No* |
| Свет |
фотон и инициализировать зрительный цикл. Таким образом, та же самая молекула опсина может многократно использоваться в зрительном возбуждении.
Из приведенной цепи реакций видно, что составленные части родопсина повторно используются в зрительном цикле. Тем не менее процесс регенерации хроматофора предполагает обязательное постоянное пополнение клеток пигментного эпителия витамином А, из которого образуется эфир 11-цис-ретинила.
В организм человека витамин А поступает с пищей и хранится в печени. Поступая в кровь, он связывается с ретинол-связывающим белком и затем с преальбумином. Этот белковый комплекс, благодаря наличию фенестр в эндотели-альной выстилке капиллярных сосудов хориои-деи, легко проникает через мембрану Бруха и достигает клеток пигментного эпителия сетчатки. Затем витамин А отделяется от белковой части комплекса и поступает в цитоплазму пигментных клеток для дальнейших преобразований в 11-цис-ретиналь.
Для восстановления родопсина необходимо пополнение и его белковой части, т. е. опсина. Пополнение фоторецепторов опсином происходит благодаря постоянно протекающему процессу регенерации наружных члеников палочек и колбочек. Вновь образованные мембранные пакеты, содержащие в своем составе и опсин, постепенно передвигаются к апикальной поверхности фоторецептора, где опсин связывается с 11-цис-ретиналем, образуя «новый» родопсин.
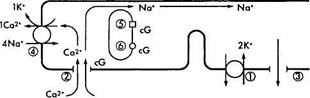
Кратко описав характер химических преобразований родопсина в процессе зрительного цикла, необходимо ответить на вопрос — каким образом описанные физико-химические процессы приводят к инициализации нервного импульса? Чтобы понять этот процесс необходимо обратиться к рис. 3.6.38. На рисунке видно, что в темновых условиях фоторецепторы деполяризованы. Это связано с тем, что натриевые каналы плазматических мембран сегментов палочек и колбочек в темноте открыты и из внеклеточного пространства в цитоплазму фоторецептора поступает большое количество ионов натрия. При этом диффузия натрия из наружного сегмента фоторецепторов во внутренний сегмент в темновых условиях обеспечивает формирование «темнового тока» [1206].
Натриевые каналы остаются открытыми благодаря высокой концентрации циклического гуанозин монофосфата (cGMP). Равновесие между ионами натрия и калия поддерживается благодаря деятельности АТФ-зависимого натрий/калиевого насоса.
Воздействие на зрительный пигмент световой энергии приводит к закрытию ионных каналов и снижению проводимости Na+ через мембрану наружного сегмента (рис. 3.6.38). При этом изменяется трансмембранный потенциал фоторецептора и возникает гиперполяризация.
Рис. 3.6.38. Схематическое изображение механизма
формирования нервного импульса в фоторецепторной
клетке:
В темноте ионы натрия (Na+), как и ионы кальция (Са+), перемещаются из наружного сегмента фоторецептора во внутренний благодаря деятельности Na+/K насоса (/), а поступают в наружный сегмент через катионные каналы (2). При этом формируется «темновой ток» ионов натрия. Катионные каналы открыты тогда, когда сСМР (cG) находится в связанном состоянии. Поток ионов натрия в направлении внутреннего сегмента происходит по мере выхода из клетки ионов калия (3). Вследствие поглощения фотона родопсином (5) активизируется фосфодиэстераза (6), что приводит к повышению концентрации cGNP и закрытию катионных каналов. Следствием этого является уменьшение проницаемости мембраны для ионов натрия и усиление ее поляризации. Посредником в этом процессе являются ионы кальция, поскольку они эффективно блокируют натриевые каналы и вызывают наблюдаемую гиперполяризацию. Выведение ионов кальция обеспечивается деятельностью ионообменника (4) и при закрытых каналах
Таким образом, фоторецепторы отвечают на освещение не потенциалами действия, а гиперполяризацией, величина которой пропорциональна интенсивности освещения.
В деполяризованном (темновом) состоянии фоторецепторы высвобождают нейромедиаторы в синаптическую щель, которые взаимодействуют с постсинаптическими терминалами биполярных и горизонтальных клеток.
Увеличение степени освещенности вызывает градуированную гиперполяризацию, которая вызывает уменьшение выделения нейромедиа-тора.
Необходимо отметить, что фоторецепторы, как и горизонтальные и биполярные клетки, не генерируют потенциалы действия, и таким образом отвечают на световую энергию уменьшением выделения медиатора [1206, 1055]. Только нейроны третьего порядка (ганглиозные клетки) генерируют потенциалы действия.
Как указано выше, индуцирует гиперполяризацию фоторецептора перекрытие ионных каналов. Изучению механизмов этого процесса
Глава 3. СТРОЕНИЕ ГЛАЗНОГО ЯБЛОКА

 посвящено большое количество исследований. Установлено, что основную роль в закрытии ионных каналов играет циклический гуанозин монофосфат (cGMP). Именно cGMP индуцирует целый каскад реакций ферментативного превращения различных белков с участием ионов кальция. Одну из центральных ролей в этом процессе играют белок-передатчик трансдуцин и фермент фосфодиэстераза. Именно фосфоди-эстераза снижает концентрацию cGMP, что и приводит к закрытию ионных каналов.
посвящено большое количество исследований. Установлено, что основную роль в закрытии ионных каналов играет циклический гуанозин монофосфат (cGMP). Именно cGMP индуцирует целый каскад реакций ферментативного превращения различных белков с участием ионов кальция. Одну из центральных ролей в этом процессе играют белок-передатчик трансдуцин и фермент фосфодиэстераза. Именно фосфоди-эстераза снижает концентрацию cGMP, что и приводит к закрытию ионных каналов.
Необходимо указать и на то, что фоторецептор не просто регистрирует световую энергию. Он также адаптируется к степени освещенности. Например, колбочки могут адаптироваться таким образом, что наша зрительная система регистрирует свет от слабых интенсивно-стей освещения до ярко освещенных солнцем объектов.
3.6.4. Нейромедиаторы
(нейротрансмиттеры) сетчатой оболочки
Описывая микроскопическое строение сетчатой оболочки, мы неоднократно упоминали о наличии определенных структурных отличий синаптической организации нейронов сетчатки. Нейроны сетчатки отличаются и используемым типом нейромедиатора при передаче информации от одного нейрона другому.
В последнее время было обращено особое внимание на изучение нейромедиаторов сетчатки, что позволило более точно дифференцировать различные типы нейронов и выявить их функцию. Развитию направления изучения нейромедиаторов способствовали успехи смежных дисциплин, таких как ауторадиография, иммунология и молекулярная биология.
Клетки, окрашенные конъюгированными к различным типам нейромедиаторов антителами, меченными пероксидазой хрена, окрашивают самые нежные нервные волокна. На основании этого возможна довольно точная дифференциация клеток, особенно при одновременной их импрегнации по Гольджи. Большинство исследований нейромедиаторов нейронов сетчатки проведено на животных, но многое и на сетчатке человека [39, 219, 453]. Необходимо отметить, что полученные данные при исследовании животных во многом совпадают с данными исследования сетчатки человека.
Перед тем как более подробно остановиться на каждом из выявленных в сетчатке нейро-медиаторе, необходимо указать, что все они обнаруживаются и в центральной нервной системе, что еще раз доказывает существование единства механизмов их развития и функционирования.
Глютаминовая кислота. Глютаминовая кислота относится к наиболее распространенным нейромедиаторам нейронов «вертикальных»
нейронных трактов сетчатки (рис. 3.6.39, а). Все фоторецепторы используют глютаминовую кислоту для передачи сигналов к нейрону следующего порядка [237, 453, 702].
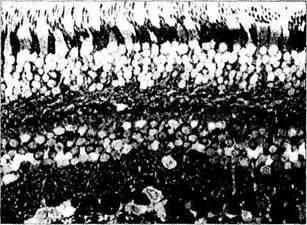
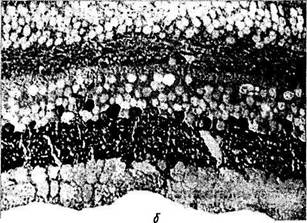
Рис. 3.6.39. Распределение глютаминовой кислоты (а) и гамма-аминомасляной кислоты (б) в нейронах сетчатой оболочки человека:
интенсивное черное окрашивание цитоплазмы клеток различных слоев сетчатки свидетельствует о положительной гистохимической реакции на выявляемый медиатор. Наиболее интенсивное окрашивание выявляется в цитоплазме ганглиозных клеток, менее интенсивное в нейронах внутреннего и наружного ядерных слоев (стрелки)
Предполагают, что глютаминовая кислота является нейромедиатором всех биполярных и большинства ганглиозных клеток сетчатки позвоночных [219, 691].
Поглощение, высвобождение и физиологическое действие глютамата и его агонистов на нейроны второго порядка подтвердило, что глютамат является нейромедиатором возбуждающего действия в первом синапсе сетчатки. Действие этого нейромедиатора на нейроны второго порядка происходит посредством двух различных типов сенсорных каналов. Один тип постсинаптического рецептора относится к ме-таботропному, а второй является ионотропным [771, 829]. Метаботропные рецепторы активи-
Сетчатка
 зируются посредством G-белка. Ионотропные рецепторы представляют собой интегральные мембранные белки, фиксирующие глютамино-вую кислоту. Этот процесс приводит к открытию катионных каналов. В настоящее время выявлен целый ряд ионотропных рецепторов [453, 847, 848].
зируются посредством G-белка. Ионотропные рецепторы представляют собой интегральные мембранные белки, фиксирующие глютамино-вую кислоту. Этот процесс приводит к открытию катионных каналов. В настоящее время выявлен целый ряд ионотропных рецепторов [453, 847, 848].
Дендриты биполярных клеток, расположенные в наружном плексиформном слое, имеют рецепторные каналы, которые относятся или к метаботропным или ионотропным. В то же время их аксоны, расположенные во внутреннем плексиформном слое, имеют каналы и рецепторы для гамма-аминомасляной кислоты (типов А, В и С), допамина и глицина. Это связано с тем, что все виды амакриновых клеток являются на этом уровне внутреннего плексиформного слоя пресинаптическими [154].
Гамма-аминомасляная кислота (ГАМК). Классический тормозной нейромедиатор, гамма-аминомасляная кислота (ГАМК), встречается во многих типах амакриновых и горизонтальных клеток у большинства позвоночных [691] Имеются некоторые противоречия при решении вопроса — содержится ли ГАМК в горизонтальных клетках обезьян и человека.
При окрашивании сетчатки человека видно, что четко окрашивается внутренний плекси-формный слой и приблизительно половина тел амакриновых клеток, лежащих во внутреннем ядерном слое. Горизонтальные клетки не окрашиваются (рис. 3.6.39, б).
Благодаря использованию двойных методов окрашивания стало известно, что амакриновые клетки типа А2, А10, А13, А17, А19 и меж-плексиформная клетка накапливают ГАМК и, вероятно, используют ее как первичный нейромедиатор. Некоторые амакриновые клетки одновременно с ГАМК используют и другие нейромедиаторы, такие как серотонин, ацетил-холин (звездчатые амакриновые клетки), допа-мин [1128], нейропептиды (вещество Р).
ГАМК-эргические амакриновые и межплек-сиформные клетки действуют на отростки биполярных, амакриновых и ганглиозных клеток или тела клеток в нейропиле сетчатки посредством всех трех типов ГАМК рецепторов.
Глицин. Глицин является аминокислотой. В центральной нервной системе и сетчатке глицин выполянет медиаторные функции. Определяется он в амакриновых клетках, не дающих реакцию на ГАМК [341, 691]. Предполагают, что к глицинэргическим относятся также несколько типов биполярных клеток. Глицин осуществляет некоторые формы постсинаптичес-кого торможения.
В сетчатке человека выявляется два морфологических типа глицинэргических амакриновых клеток. Менее интенсивно окрашиваются клетки типа АН. Более интенсивно окрашиваются клетки А4 и А8 [841, 842]. Глициновые рецепторы также найдены на всех нейронах,
являющихся постсинаптическими по отношению к амакриновым клеткам — на аксонах биполярных клеток, на дендритах ганглиозных клеток. Обнаружены глициновые рецепторы и в мюллеровских клетках [265].
Допамин. Нейромодулятор допамин обнаруживается в нескольких типах амакриновых клеток сетчатки млекопитающих. Наиболее интенсивно окрашивается при проведении иммуно-гистохимической реакции амакриновая клетка типа А18 [600].
Допаминовая клетка первого типа (А18) образует синапс на амакриновой клетке палочки АН и, возможно, также на клетках А8 и А17 [179, 591, 843, 1150].
Второй тип допаминовой амакриновой клетки был описан у обезьян и человека [694]. Эта клетка отдает дендриты, распределяющиеся в 3-м слое (страте) внутреннего плексиформного слоя.
Допаминовые клетки первого типа обеспечивают функционирование восходящих путей, направляющихся к наружному плексиформному слою. В этом слое они образуют синапсы с ГАМК-эргическими межплексиформными клетками.
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 713; Нарушение авторских прав?; Мы поможем в написании вашей работы!