
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
HO–СH2–СН(ОН)–CH2–OH
|
|
|
|
В зависимости от того, с каким атомом углерода (первичным,
вторичным или третичным) связана гидроксигруппа, различают спирты:
первичные R–CH2–OH, вторичные R2CH–OH, третичные R3C–OH.
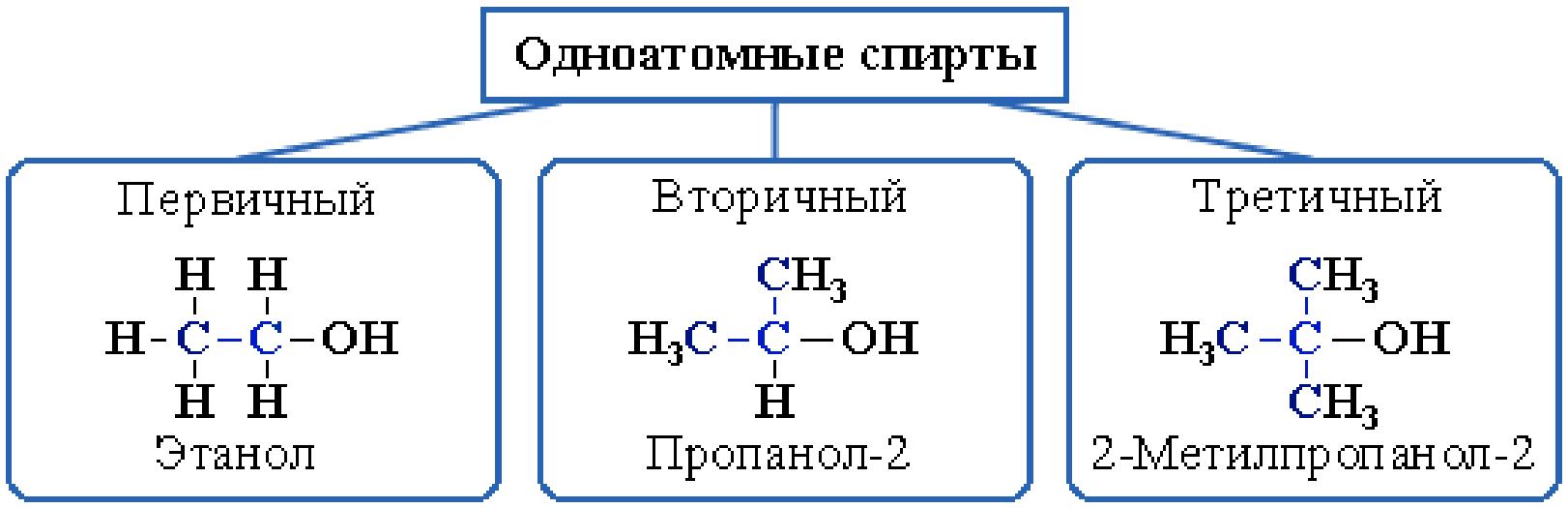
Общая формула гомологического ряда алифатических одноатомных спиртов имеет вид СnН2n+1ОН.
Фенолы – гидроксисоединения, в молекулах которых ОН-группы связаны непосредственно с атомами углерода бензольного ядра.

Классификация фенолов. В зависимости от числа ОН-групп различают: одноатомные фенолы (например, вышеприведенные фенол и крезолы) и многоатомные. Среди многоатомных фенолов наиболее распространены двухатомные:
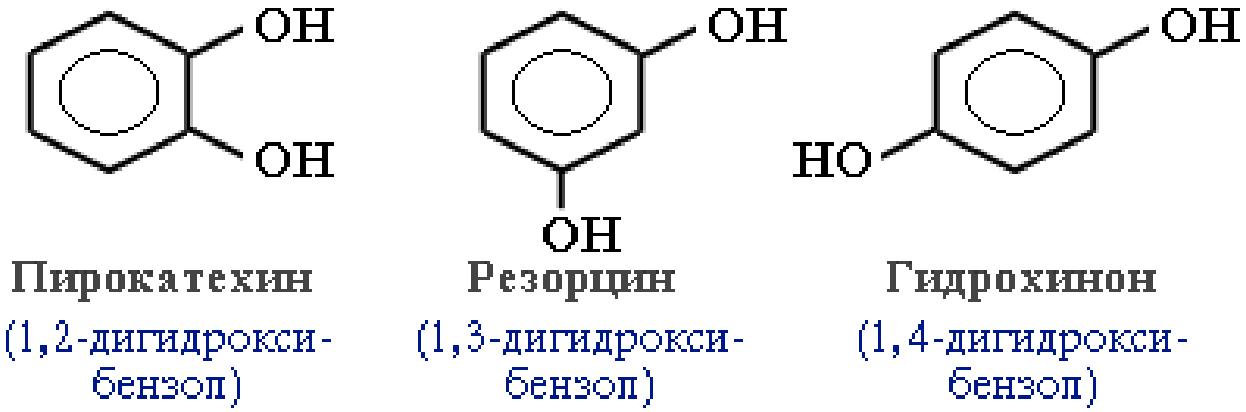
|
Химические свойства
Спирты, обладающие очень слабо кислыми свойствами, реагируют только с металлами. Спирты – более слабые кислоты, чем вода.
2 С2Н5О H + 2 Na → 2 C2H5ONa + H2
этанол этилат натрия
Алкоголяты - соли, образованные очень слабой кислотой и сильным основанием, способны гидролизоваться и водный раствор будет иметь щелочную реакцию (опыт 6).
С НsОNa + H-OH → C2H5OH + NaOH
этилат натрия этанол
Фенолы являются более сильными кислотами, чем спирты и вода, т.к. за счет участия неподеленной электронной пары кислорода в сопряжении с л-электронной системой бензольного кольца полярность связи О-Н увеличивается. Фенолы - это кислоты, поэтому могут реагировать как с металлами, так и гидроксидами щелочных и щелочноземельных металлов, образуя соли - феноляты
С6Н5ОН + NaOH → C6H5ONa + Н20
фенол фенолят натрия
C6H5ONa + НС1 → С6Н5ОН + NaCl
фенолят натрия фенол
Многоатомные спирты, в отличие от одноатомных, взаимодействуют с раствором гидроксида меди (II), образуя комплексные соединения, окрашивающие раствор в ярко-синий цвет (качественная реакция):
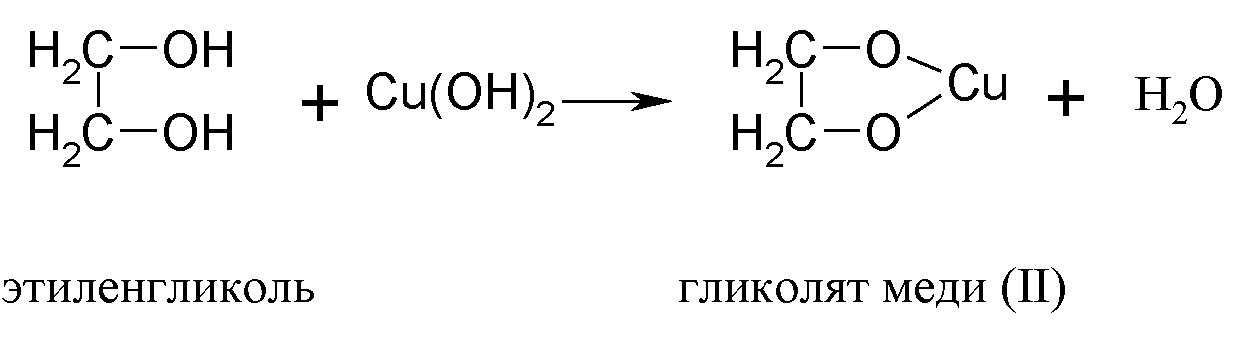
|
В спиртах гидроксильная группа подвижна, дает многие реакции обмена, в частности, реагирует с минеральными кислотами.

Таким образом, спирты проявляют амфотерные свойства.
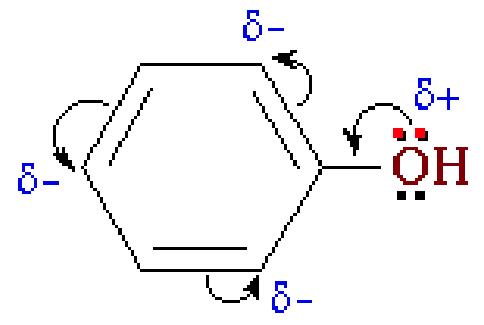
Поэтому фенол значительно активнее бензола вступает в реакции замещения в ароматическом кольце.
Для спиртов характерна реакция дегидратации, идущая в присутствии концентрированной серной кислоты. В зависимости от температурных условий образуются различные вещества:
а) межмолекулярная дегидратация с образованием алкенов идет в присутствии концентрированной серной кислоты при нагревании ниже 140 °С.
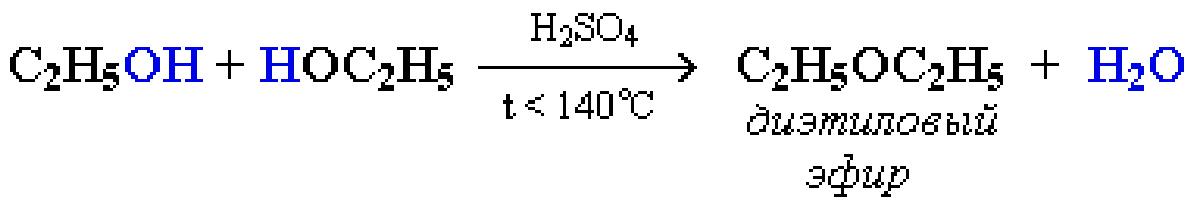
б) внутримолекулярная дегидратация идет в присутствии концентрированной серной кислоты при нагревании выше 140°С, с образованием непредельных углеводородов.

В тех случаях, когда возможны 2 направления реакции, дегидратация идет преимущественно в направлении I, т.е. по правилу Зайцева – с образованием более замещенного алкена (водород отщепляется от менее гидрогенизированного атома углерода).
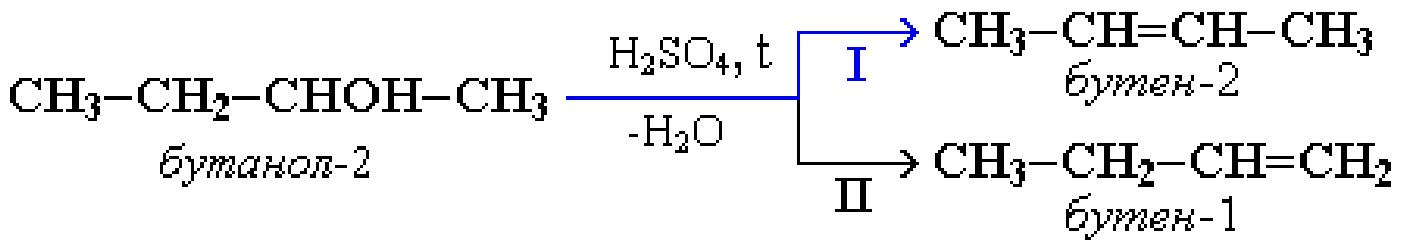
Первичные спирты при окислении (KMnO4, K2Cr2O7+H2SO4, O2+катализатор) образуют альдегиды, которые затем легко окисляются до карбоновых кислот.
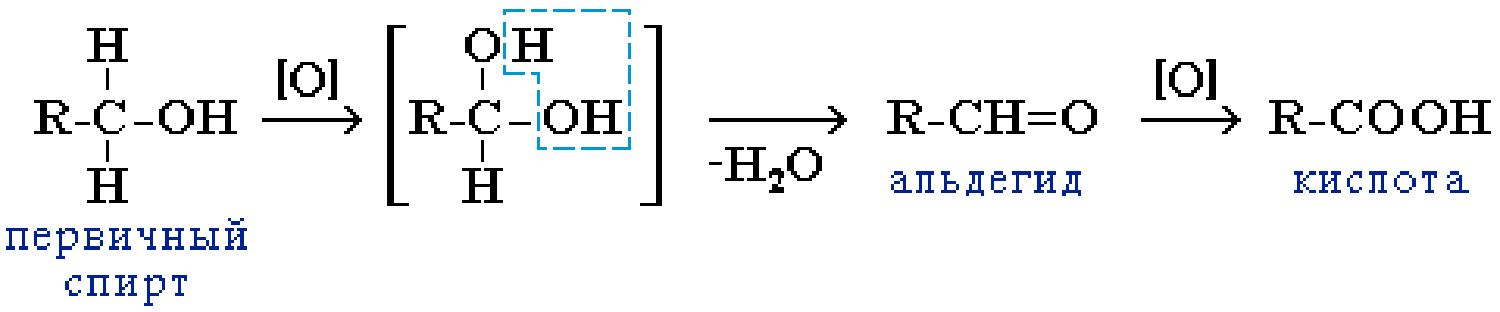
| Вторичных спиртов при окислении образуют кетоны. |
Третичные спирты более устойчивы к действию окислителей, чем первичные и вторичные спирты. Их окисление происходит в жестких условиях и приводит к разрыву С-С -связей с образованием кислот и кетонов меньшей молекулярной массы.
Контрольные задания №1
Напишите уравнения реакций образования алкоголята и разложения его водой:
| 1) | бариевого алкоголята изопропилового спирта | 2) | натриевого алкоголята вторичного бутилового спирта |
| 3) | литиевого алкоголята 1-пентанола | 4) | кальциевого алкоголята 2-метил-2-пропанола |
| 5) | калиевого алкоголята третичного гексилового спирта | 6) | магниевого алкоголята 2-бутанола |
| 7) | калиевого алкоголята 3-гексанола | 8) | литиевого алкоголята третичного бутилового спирта |
| 9) | стронциевого алкоголята 3-метил-2-бутанола | 10) | алюминиевого алкоголята 1-пропанола |
| 11) | этилата алюминия | 12) | пропилата бария |
| 13) | бутилата кальция | 14) | метилата алюминия |
| 15) | литиевого алкоголята 2-бутанола | 16) | метилата бария |
| 17) | этилата лития | 18) | магниевого алкоголята изопропанола |
| 19) | изопроплата натрия | 20) | этилата бария |
| 21) | изопропилата алюминия | 22) | бутилата магния |
| 23) | калиевого алкоголята 2-пентанола | 24) | магниевого алкоголята третичного бутилового спирта |
| 25) | бариевого алкоголята третичного бутилового спирта | 26) | изопропилата кальция |
Контрольные задания №2
Для следующих фенолов напишите уравнения реакций с раствором гидроксида натрия и разложения полученных фенолятов разбавленной серной кислотой:
| 1) | 2-нафтола | 2) | мета-нитрофенола |
| 3) | орто-хлорфенола | 4) | 2,6-динитрофенола |
| 5) | мета-крезола | 6) | гидрохинона |
| 7) | мета-нитрофенола | 8) | пара-бромфенола |
| 9) | 5-бром-1-нафтола | 10) | орто-изопропилфенола |
| 11) | мета- фторфенола | 12) | орто-гидроксибензойной кислоты |
| 13) | 4-метил-1-нафтола | 14) | 5-бром-1-нафтола |
| 15) | резорцина | 16) | орто-нитрофенола |
| 17) | пара-хлорфенола | 18) | орто-метилфенола |
| 19) | мета-пропилфенола | 20) | пара-нитрофенола |
| 21) | мета-хлорфенола | 22) | пара-этилфенола |
| 23) | 2,4,6-тринитрофена | 24) | орто-пропилфенола |
| 25) | 1-нафтола | 26) | 2-нафтола |
Контрольные задания №3
Напишите уравнения реакций окисления следующих спиртов, укажите условия реакций, назовите продукты:
| 1) | 3,3-диметил-1-бутанола | 2) | 2-бутанола |
| 3) | 4-метил-1-пентанола | 4) | 3-метил-2-бутанола |
| 5) | 2-метил-1-пропанола | 6) | 3-метил-2-пентанола |
| 7) | 3,3-диметил-2-пентанола | 8) | 4-метил-2-пентанола |
| 9) | 2-метил-1-пентанола | 10) | 2-пентанола |
| 11) | 3-метил-2-гексанола | 12) | 3-гексанола |
| 13) | 1-пентанола | 14) | 2-метил-1-гексанола |
| 15) | 1-гептанола | 16) | изопропанола |
| 17) | бензилового спирта | 18) | 2-пропанола |
| 19) | мета-метилбензилового спирта | 20) | 2,3-диметилпентанола |
| 21) | 2,4-диметил-3-пентанола | 22) | этандиола |
| 23) | 1,3-пропандиола | 24) | глицерина |
| 25) | 3-метил-2-гексанола | 26) | 2-гептанола |
Альдегиды и кетоны (карбонильные соединения)
Карбонильными соединениями называют органические вещества, в молекулах которых содержится карбонильная группа >С=О. Общая формула карбонильных соединений
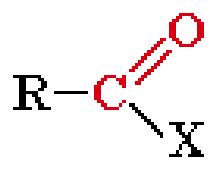
Классификация карбонильных соединений. В зависимости от типа заместителя Х эти соединения подразделяют на: альдегиды (Х = Н); кетоны (Х = R, R');
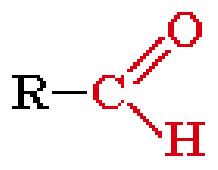
Альдегиды - органические соединения, в молекулах которых атом углерода карбонильной группы связан с атомом водорода. Функциональная группа –СН=О называется альдегидной.
|
R = Н, алкил, арил
Кетоны - органические вещества, молекулы которых содержат карбонильную группу, соединенную с двумя углеводородными радикалами.
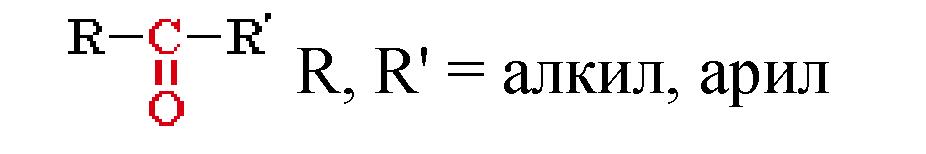
|
Тривиальные названия альдегидов производят от тривиальных названий тех кислот, в которые альдегиды превращаются при окислении.
| Формула | Название | |
| систематическое | тривиальное | |

| метан аль | муравьиный альдегид (формальдегид) |

| этан аль | уксусный альдегид (ацетальдегид) |

| 2-метил-пропан аль | изомасляный альдегид |

| бутен-2- аль | кротоновый альдегид |
Важнейшие химические свойства альдегидов и кетонов. Для карбонильных соединений наиболее характерными являются реакции: присоединения по карбонильной группе; полимеризации; конденсации; восстановления и окисления. Большинство реакций присоединения, характерных для альдегидов и кетонов протекают по связи С=О. Реакционная способность в таких реакциях уменьшается от альдегидов к кетонам:
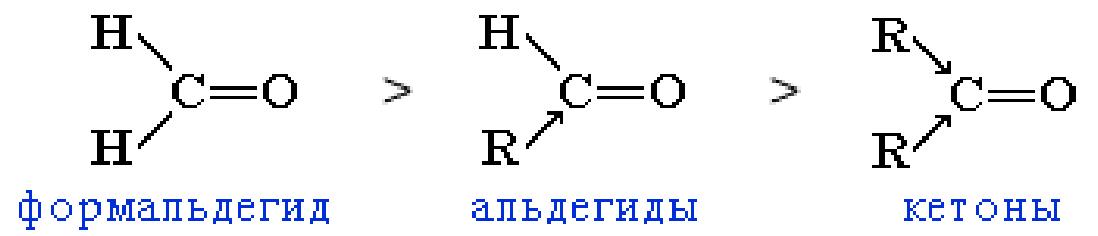
Это объясняется, главным образом, двумя факторами: углеводородные радикалы у группы С=О затрудняют присоединение к карбонильному атому углерода новых атомов или атомных групп; углеводородные радикалы за счет +I-эффекта уменьшают положительный заряд на карбонильном атоме углерода, что затрудняет присоединение нуклеофильного реагента.
Реакции присоединения идут в мягких условиях.
1. Присоединение циановодородной (синильной) кислоты HCN:
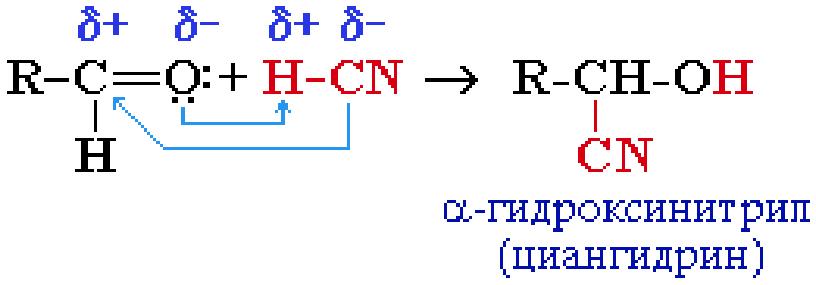
Эта реакция используется для удлинения углеродной цепи, а также для
получения –гидроксикислот.
2. Присоединение спиртов с образованием полуацеталей (в
присутствии кислоты или основания как катализатора):
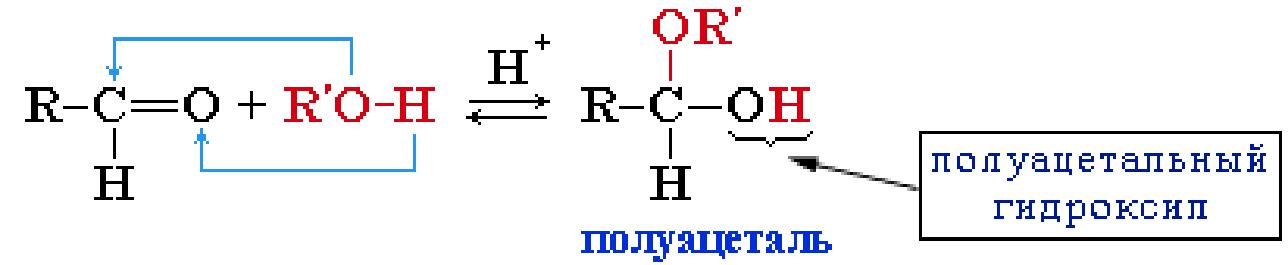
Полуацетали - соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами. Взаимодействие полуацеталя с еще одной молекулой спирта (в присутствии кислоты) приводит к замещению полуацетального гидроксила на алкоксильную группу OR' и образованию ацеталя:
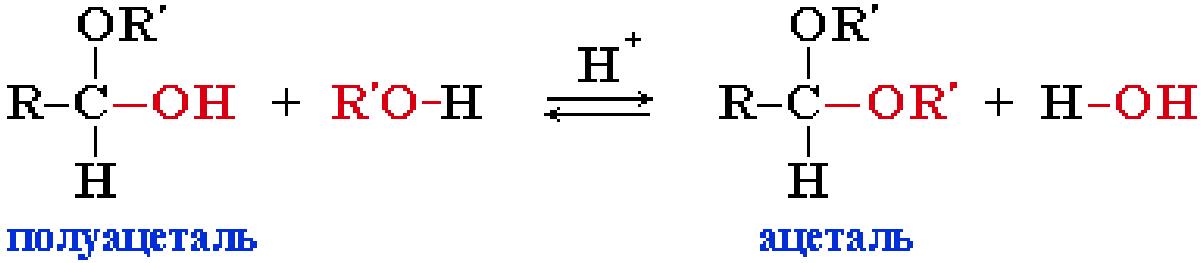
Ацетали - соединения, в которых атом углерода связан с двумя алкоксильными (-OR)группами. Образование ацеталей из полуацеталей подобно реакции получения простых эфиров при межмолекулярной дегидратации спиртов. Реакции карбонильных соединений со спиртами играют важную роль в химии углеводов.
3. Реакция присоединения-замещения с гидроксиламином с образованием оксимов:

|
1. Конденсация с фенолами. Практическое значение имеет реакция формальдегида с фенолом (катализаторы – кислоты или основания):
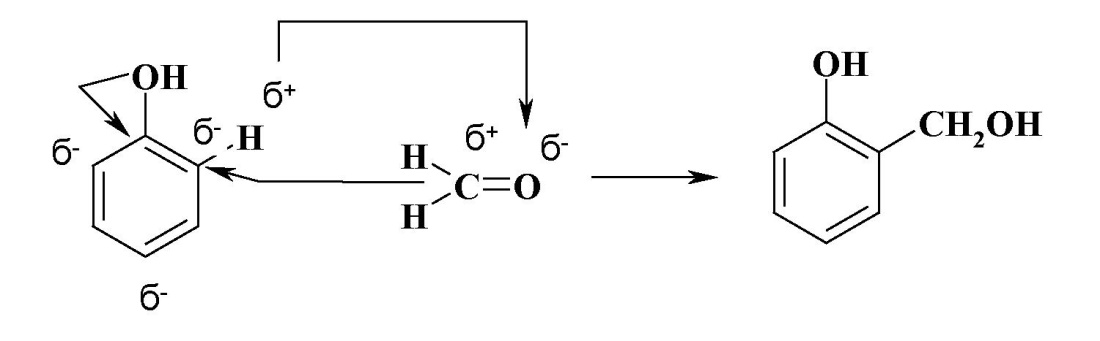
|
Реакции восстановления альдегидов и кетонов. Альдегиды при взаимодействии с водородом в присутствии Ni-катализатора (реакция восстановлеия) образуют первичные спирты, кетоны - вторичные:


|
В лабораторных условиях для восстановления альдегидов и кетонов используется алюмогидрид лития LiAlH4
Реакции окисления альдегидов и кетонов. Реакции окисления альдегидов идут значительно легче, чем кетонов. Альдегиды очень легко окисляются в соответствующие карбоновые кислоты под действием таких мягких окислителей, как аммиачный раствор оксида серебра [Ag(NH3)2]OH. (качественные реакции на альдегидную группу):
а) реакция "серебрянного зеркала" - окисление аммиачным раствором оксида серебра:
R–CH=O + 2[Ag(NH3)2]OH → RCOOH + 2Ag + 4NH3 + H2O
Кетоны окисляются сильными окислителями (K2Cr2O7 + H2SO4; KMnO4 + H2SO4) с разрывом цепи атомов углерода около карбонильной группы, преимущественно по 1 направлению.

|
В ароматическом ряду карбонильная группа является ориентантом II-рода, и направляет заместители в мета положение по отношению к себе.

|
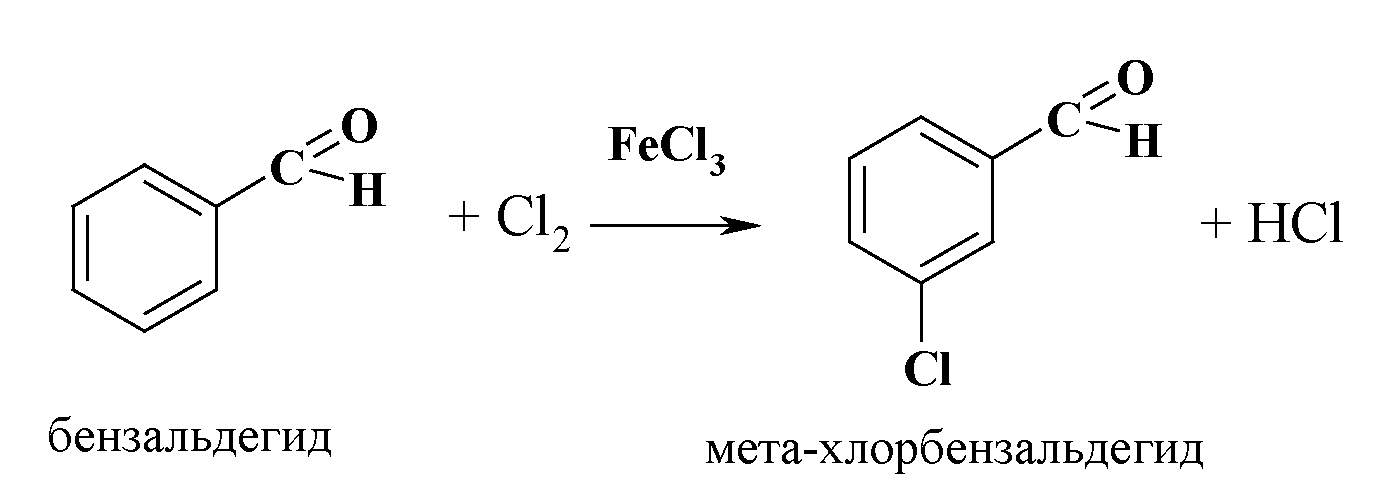
|
Контрольные задания
Напишите уравнения реакций с гидросульфитом натрия и синильной кислотой для следующих веществ:
| 1) | 3-метилбутаналя | 2) | 2,3-диметилпентаналя | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3) | 2-бутанона | 4) | 2-пентанона | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5) | 2-этилпентаналя | 6) | 2,4-диметилгексаналя | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7) | 3-метил-2-гексанона | 8) | 3-этилгексаналя | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| 9) | 2,4-диметилпентаналя | 10) | 3,3-диметилгексаналя | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| 11) | 2,4-диметил-3-пентанона | 12) | 3-метил-2-бутанона | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| 13) | 3,3-диметилбутаналя | 14) | 2-метилбутаналя | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| 15) | 2,2-диметилпентаналя | 16) | пропаналя | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| 17) | бутаналя | 18) | орто-метилбензойного альдегида | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| 19) | метил-фенилкетона | 20) | 2-этилбутаналя | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| 21) | мета-этилбензойного альдегида | 22) | пара-гидроксибензойного альдегида | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| 23) | 2-метил-гексаналя | 24) | 3,4-диметилпентаналя | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| 25) | 2,4-диметил-3-пентанона Индивидуальные задания Напишите уравнения следующих реакций, назовите продукты:
| 26) | 3-этилпентаналя |
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 11735; Нарушение авторских прав?; Мы поможем в написании вашей работы!