
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Умови отримання і склад нітридів, одержаних азотизацією металів
|
|
|
|
(1 – розрахунковий вміст елементів; 2 – отриманий вміст елементів)
| Нітрид | Умови синтезу | Уміст, % | ||||
| Температура, ºС | Тривалість витримки, год | Ме | N | |||
| TiN | 2...6 | 77,35 | 77,5 | 22,65 | 22,2 | |
| ZrN | 1...2 | 86,69 | 86,5 | 13,31 | 13,2 | |
| ZrN | 2...4 | 86,69 | 86,80 | 13,31 | 11,8 | |
| HfN | 1..2 | 92,78 | 92,85 | 7,28 | 7,1 | |
| VN | 3...4 | 78,50 | 78,20 | 21,50 | 20,3 | |
| W3N | 90,70 | 90,60 | 9,30 | 8,60 | ||
| NbN | 86,90 | 86,90 | 13,10 | 13,10 | ||
| Nb2N | 0,5...1,0 | 92,80 | 97,82 | 3,02 | 6,60 | |
| TaN | 1...2 | 92,88 | 92,60 | 7,19 | 7,30 | |
| CrN | 1...2 | 78,30 | 78,60 | 21, 70 | 21,00 | |
| Cr2N | 1200...1300 | 88,13 | 88,00 | 11,87 | 11,95 | |
| Mo2N* | - | - | - | - | ||
| W2N | 0,1...1,0 | - | - | - | - |
* У разі отримання в середовищі аміаку.
Перспективним синтезом нітридів з елементів є метод СВС, суть якого було розглянуто стосовно отримання карбідів. Апаратурне оформлення процесу отримання нітридів аналогічно отриманню карбідів. Як вихідні матеріали використовують зазвичай дисперсні порошки металів і газоподібний азот. При цьому тиск азоту може змінюватися в межах 1...2 ГПа. Наявність одного з реагентів у газоподібному стані дозволяє віднести процес синтезу нітридів до горіння фільтрації. Газ, що реагуює, до зони горіння надходить мимовільно за рахунок різниці тисків у фронті горіння і навколишньому середовищі. Горіння фільтрації складніший тип горіння за СВС, ніж безгазовий. Для його здійснення необхідно дотримувати ряд умов. Це, перш за все, збереження досить високої газопроникності компонента в твердому стані та утвореного в процесі горіння продукту, що необхідно для забезпечення доставляння газоподібного азоту до фронту горіння. Крім того, як і в разі синтезу карбідів, дуже важливо запобігти тепловідведенню в навколишнє середовище.
Одна з найважливіших особливостей горіння фільтрації — наявність двох стадій процесу відповідно до нерівноважної адіабатичної структури хвилі синтезу (рис. 7.6). Під час синтезу нітридів завжди наявні зони горіння і догоряння — об’ємного дореагування шихти, розігрітої хвилею горіння. Наявність двох стадій процесу отримання нітридів зумовлено тим, що спочатку нітрид утворюється на поверхні частинок у вигляді щільної захисної плівки, що перешкоджає дифузійному проникненню азоту вглиб частинки металу, що сильно гальмує процес і призводить до недогоряння. Для отримання в цьому випадку однофазних кінцевих продуктів необхідно забезпечити повноту проходження процесу на стадії догоряння. Труднощі, пов’язані з механізмом фільтрації горіння, особливо характерні для процесів отримання високоазотованих продуктів, коли в зоні горіння майже завжди відчувається брак азоту. Для забезпечення умов синтезу нітридів потрібно застосовувати м’якші режими. Це досягається введенням до складу вихідного порошку металу порошку однойменного нітриду (10...50 %) для зниження температури процесу СВС нітридів перехідних металів, що має не перевищувати 2000 °С.
За оптимальних умов проведення СВС нітридів відбувається повне перетворення вихідних речовин у кінцеві. При цьому кількість непрореагованого матеріалу зазвичай не перевищує 0,01...0,20 %. Ступінь чистоти одержуваних продуктів визначається ступенем чистоти вихідних компонентів, оскільки забруднення в процесі синтезу не відбувається. Основна домішка в нітридах ― кисень, уміст якого в деяких випадках може досягати 0,5 %. Склади деяких нітридів, одержуваних методом СВС, наведено в табл. 7.8.
Для виробництва нітридів дедалі більшого застосування набуває метод плазмохімічного синтезу. Як вихідні речовини при цьому використовують порошки металів, їх галогеніди, оксиди, які вводять або безпосередньо в зону розряду, або у високотемпературний струмінь плазми поза зоною розряду. При цьому процес синтезу нітридів спрощується, оскільки азот, будучи плазмоутворювальним газом, одночасно є і компонентом реакції утворення нітридів. Серед газів, використовуваних як плазмоутворювачі (Аг, Не, Н2, N2, О2), азот має найбільшу питому теплоту згоряння в такому самому інтервалі температур, який підтримують при плазмохімічному синтезі (рис. 7.9). У цьому ж інтервалі температур основний компонент азотної плазми ― це переважно атомарний азот, чим і визначається його висока хімічна активність.
Таблиця 7.8
Склад нітридів, одержаних методом СВС
| Нітрид | Уміст, % | |||
| Ме | N | |||
| Розрахунковий | Практичний | Практичний | Практичний | |
| TiN ZrN HfN NbN ТаN | 77,30 86,69 92,73 86,91 92,92 | 77,1 87,5 92,1 87.2 92,2 | 22,62 13,31 7,24 13,09 7,18 | 21,7 12,8 7,2 12,9 7,3 |
В основі процесу утворення нітридів згідно з плазмохімічним методом синтезу, як і в разі отримання їх іншими методами, лежить дифузія азоту вглиб частинок металу. При цьому макроскопічність частинок призводить до зменшення ступеня насичення азотом. Оскільки в умовах дугового розряду швидкості плазмових струменів високі, дифузія не відбувається до кінця, наслідком чого є зазвичай утворення сполук нестехіометричного складу і наявність в кінцевих продуктах вихідних металів, що не прореагували.
Як вихідні матеріали доцільно використовувати галогеніди металів, зокрема хлориди. Якщо вводяться хлориди в плазмовий струмінь, вони розкладаються, утворюючи найдрібніші частинки металів або їх пари. Нітриди утворюються з газової фази в разі взаємодії пари металу з азотом. У результаті розміри утворюваних частинок продукту дорівнюють десяткам нанометрів. Так, наприклад, у разі взаємодії тетрахлориду титану з азотною плазмою можна одержати нітрид титану, склад якого близький до стехіометричного, розмір частинок становить 30 нм, а питома поверхня — 45 м2/г. У процесі його отримання досягається ступінь перетворення хлориду 100 %, а вихід готового продукту становить 98 %.
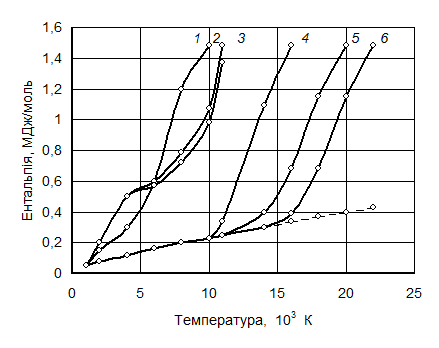
Рис. 7.9. Температурна залежність ентальпії Н деяких газів:
1 – N2; 2 – O2; 3 – Н2; 4 – Аг; 5 – Кг; 6 – Не
Отримання нітридів відновленням оксидів металів твердим відновником у середовищі азоту. Основою процесу є реакція
МеО + Ме (Х) + N2 ®МеN + МеО (Х О),
де Ме — метал-відновник; Х — неметалевий відновник (вуглець, силіцій, бор).
Найчастіше як відновник використовують вуглець, що разом з утворенням нітридів утворює карбіди відновлюваних металів як неперервний ряд твердих розчинів. Тому цей метод застосовують здебільшого для отримання нітридів технічної чистоти – зазвичай нітридів титану, цирконію, ванадію, ніобію і гафнію.
Для зменшення вмісту вуглецю в одержуваному продукті процес належить провадити за максимально можливих низьких температур, що знижує імовірність утворення карбідів.
На швидкість процесу отримання нітридів істотно впливає газопроникність ущільненої шихти залежно від розміру пор і геометричної форми брикетів. Реакції відновлення з подальшою азотизацією перебігають, головним чином, усередині пор шихти. Тому важливе значення має швидкість відведення із зони реакції СО і доставляння у зворотному напрямі азоту. Якщо швидкість циркуляції цих газів перевищить швидкість реакції утворення нітридів, то процес лімітуватиметься останнім. Уповільнення швидкості відведення оксиду вуглецю із зони реакції зумовить підвищення його парціального тиску в порах і зниження тиску азоту, що, у свою чергу, призведе до утворення карбідів, а отже, й до забруднення продукту вуглецем.
Оптимальні режими отримання нітридів грунтуються на врахуванні рівноважних і кінетичних особливостей перебігу реакцій відновлення і азотування. Так, наприклад, для отримання нітридів титану і ніобію оптимальні температури відповідно 1250 і 1400 °С за тривалості ізотер-мічного витримування для гранульованих шихт 3...4 год, тиску азоту
0,4 МПа і швидкості його подачі 0,18 м/с. У цьому разі нітрид титану містить 0,5...0,7 % вуглецю, а в нітриді ніобію його немає.
Отримання нітридів термічною дисоціацією сполук. Процес отримання нітридів можна провадити в печах опору різного типу, серед яких частіше застосовуються печі періодичної і неперервної (револьверного типу) дії з перемішуванням шару гранульованої шихти вібрацією. Вихідні компоненти (оксид, сажа) змішують і в разі потреби додатково подрібнюють у кульових млинах. Одержану суміш гранулюють або пресують в таблетки невеликих розмірів, використовуючи як пластифікатор водний розчин полівінілового спирту. Підготовлена таким чином шихта має добру рухливість і газопроникність, що забезпечує повний перебіг реакцій відновлення і азотування, неперервність технологічного процесу.
Для проведення процесу в печах револьверного типу застосовуються режими, наведені в табл. 7.9. Одержані при цьому нітриди за складом близькі до розрахункових.
Отримання нітридів осадженням з газової фази. Метод має важливе значення у зв’язку з можливістю отримання продукту високого ступеня чистоти в полі- і монокристалічному стані. Як і в разі отримання інших сполук, за цим методом як вихідні речовини використовують галогеніди відповідних металів. Процес провадять за наявності азоту вищого ступеня очищення або аміаку і водню. Нітриди утворюються за однією зі схем:
МеС14 + NНз®MеN + НС1;
МеOCl2 + NНз ® МеN+ Н20 + НС1;
МеС1 + N2 + Н2 ® МеN + НС1.
Таблиця 7.9
Склад і режими отримання нітридів в печах револьверного типу відновленням оксидів металів вуглецем з одночасною азотизацією
| Нітрид | Температура, оС | Тривалість витримування, год | Уміст, % | |||
| Ме | N | |||||
| Розра- хун- ковий | Прак- тичний | Розра- хун- ковий | Прак-тичний | |||
| TiN | 1,5 | 87,37 | 78,3…79,0 | 22,63 | 20,0...21,7 | |
| ZrN | 86,69 | 87,0…87,5 | 13,31 | 12,5...13,2 | ||
| 92,72 | 92,7…93,0 | 7,28 | 6,9...7,3 | |||
| VN | 88,44 | 78,8...80,8 | 21,56 | 18,0...20,5 | ||
| NЬN | 86,9 | 86,9...87,7 | 13,10 | 12,3...13,0 | ||
| ТаN | 1,5 | 92,81 | 92,8…93,2 | 7,19 | 6,7...6,9 | |
| Сг2N | 88,14 | 86,7…87,7 | 11,86 | 10,7...11,3 |
Температурні режими наведено в табл. 7.10.
Апаратурне оформлення процесу осадження нітридів з газової фази подібне до оформлення процесу отримання інших тугоплавких сполук з газової фази. Найчастіше нітриди осідають на нагрітій вольфрамовій нитці. Чим тонша нитка, тим швидше починається реакція. Найчастіше осад нітриду є конгломератами рихлої і пористої структури. Величина утворюваних кристалів залежить від температури нитки. За низьких температур утворюються дрібні кристали. Із підвищенням температури розмір кристалів і міцність їх зчеплення з підкладкою збільшуються. Прискоренню процесу утворення нітридів сприяє розвинена поверхня
нитки. За високої і стабільної температури нитки, що має монокристалічну структуру або складається з витягнутих зерен, утворюються монокристалічні осади. Можливе також отримання нітридів з газової фази у вигляді дисперсних осадів. Так, у разі отримання нітриду титану в основі процесу лежить реакція
2ТiС14 + 2NН3 = 2ТiN + 6НС1 + Сl2,
що перебігає за температури понад 1000 °С. Сутність технології полягає в подачі заздалегідь нагрітих до 700...900 °С тетрахлориду титану й аміаку в кварцову реакційну камеру через форсунку, по внутрішньому каналу якої подається тетрахлорид, а по зовнішньому кільцевому простору — аміак. У газовій фазі необхідно забезпечити співвідношення два-чотири молі аміаку на один моль ТiС14. Середня температура в камері має бути не нижчою 750...950 °С, а безпосередньо на виході—1000...1200 °С, що забезпечить високий ступінь перебігу реакції. Важливим також є забезпечення ламінарних потоків газів у реакційному просторі за швидкості їх руху 2... 20 м/с. У цих умовах продукт, що виходить з реакційної камери, складається з тонкої суспензії нітриду в газовому середовищі, що складається з хлору, пари НС1, реагентів, що не прореагували. Цю суміш охолоджують у трубчастих теплообмінниках з подальшим відділенням нітриду електростатичним осадженням і фільтрацією на керамічних фільтрах. Одержаний таким чином нітрид ― порошок з розміром частинок 0,1...0,6 мкм і вмістом азоту 22,2... 22,6 %.
Таблиця 7.10
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 544; Нарушение авторских прав?; Мы поможем в написании вашей работы!