
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Газоподібний утворюваний силіцій, взаємодіючи з вуглецем, утворює силіцію
|
|
|
|
Отримання порошків неметалевих тугоплавких сполук
Температурні режими отримання силіцидів осадженням з газової фази
| Силіцид | Вихідний компонент | Температурний інтервал, °С |
| TiSi2 ZrSi2 NbSi2 TaSi2 CrSi2 MoSi2 WSi2 | Тi + SiCl4+ Н2 Zг + SiСl4 + Н2 NЬ + SiCl4 +Н2 Та + SiC14 + Н2 Сг+ SiCl4 + H2 Мо + SiCl4 + Н2 W + SiCl4 + Н2 | 1100…1500 1100…1500 1100…1800 1100…1800 1100…1400 1100…1800 1100…1800 |
Механізм утворення силіцидів має дифузійний характер. При цьому силіциди утворюються у напрямі збагачення нижчих силіцидів силіцієм. Так, наприклад, процес утворення дисиліциду титану можна подати схемою
Ti5Si3 ®Ti5Si4 ®TiSi ®TiSi2 ®Si(Ti).
Метод отримання силіцидів осадженням з газової фази має практичне значення для отримання захисних покриттів, особливо з дисиліцидів молібдену і вольфраму, що має високу жаростійкість і хімічну стійкість до агресивних середовищ.
Отримання силіцидів електролізом розплавлених середовищ. Силіциди тугоплавких металів можна одержувати електролізом розплавлених середовищ аналогічно отриманню інших тугоплавких сполук. Для цього використовують розплави фторсилікатів калію або натрію і оксиди або солі металевого компонента. Для отримання дисиліцидів титану, цирконію і хрому використовують розплави силікатів у суміші з оксидами тугоплавких лужних металів. Силіциди виділяються на катоді у вигляді правильних кристалів. Метод промислового значення не має.
Серед неметалевих тугоплавких сполук найширшого застосування набули карбід силіцію SiC, карбід бору В4С, нітрид силіцію Si3N4 і нітрид бору ВN. Завдяки своїй виключно високій твердості та іншим специфічним властивостям ці сполуки широко застосовують передусім в інструментальній і оброблювальній промисловості, а також входять до складу зносостійких і хімічно тривких матеріалів.
Карбід силіцію. Карбід силіцію можна одержати такими методами:
1) прямим синтезом з елементів;
2) відновленням оксиду силіцію (IV) вуглецем;
3) кристалізацією з розчинів-розплавів;
4) осадженням з газової фази.
Найширшого застосування набув метод отримання карбіду силіцію взаємодією кремнезему з вуглецем за сумарною реакцією
SiO2 + 3C ® SiC + 2CO.
Процес має дві стадії. Спочатку кремнезем відновлюється до металевого силіцію, який, взаємодіючи з вуглецем, утворює карбід силіцію. Проте залежно від температурних умов можливий перебіг проміжних реакцій. Так, спочатку може утворитися оксид силіцію (II) за реакцією
SiO2 + С = SiO2 + CO,
який потім відновлюється вуглецем до елементарного силіцію:
SiO + С = Si + CO.
Si + С = SiC.
У промислових обсягах процес отримання карбіду силіцію провадять у керновій печі опору (рис. 7.11).

Рис. 7.11. Перетин кернової печі до початку (а) і після закінчення (б) процесу
отримання SiC: 1 – шихта; 2 – силіксикон; 3 – аморф; 4 – карбід силіцію (друзи);
5 – шар графіту; 6 – керн
Технологічну схему виробництва SiС показано на рис.7.12.
Як вихідні матеріали використовують кварцовий пісок, нафтовий кокс, а як основне джерело вуглецю ― кам’яну сіль, деревну тирсу і поворотні матеріали.
Кількість карбіду силіцію, ступінь його чистоти і кристалізації залежать від чистоти кварцового піску і вуглецевої сировини. Для складання шихти використовують нафтовий кокс марки КЗ-0, розмір частинок яких менший за 2 мм. Проте основна фракція повинна мати розмір частинок менший за 1 мм, що потрібно для забезпечення потрібного розміру реакційної поверхні і, отже, швидкості утворення карбіду силіцію. Розмір частинок SiO2 має перевищувати розміри частинок коксу не менше, ніж у три рази. Окрім SiO2 і нафтового коксу, в шихту додають антрацит, деревну тирсу (для розпушування) і поворотну шихту, а для отримання зеленого карбіду силіцію — кам’яну сіль.

Рис. 7.12. Технологічна схема виробництва карбіду силіцію
Кам’яна сіль виконує роль рафінуючої домішки, оскільки сприяє видаленню домішок із зони реакції у вигляді хлоридів. Крім того, вона виконує функцію перерозподілу температури по зонах печі, тобто переміщує теплоту з внутрішніх зон печі до зовнішніх через шунтування струму і випаровування — конденсації солі.
Для виробництва зеленого карбіду силіцію температура керна має становити 1400 °С і досягає 8…9 год від початку роботи печі, а для виробництва чорного карбіду силіцію — через 5…6 год.
У процесі виробництва зеленого карбіду силіцію протягом перших 5…6 год від початку роботи печі відбувається розігрівання керна і видалення з нього летких речовин та вологи. Керн і довколишні шари шихти нагріваються до температури 850…900 °С. Через 8…9 год спостерігається різке підвищення температури і прогрівання шихти у всій реакційній зоні. Це пов’язано з плавленням кам’яної солі та підвищенням теплопровідності й електропровідності шихти. У реакційній зоні створюються умови для проходження реакцій відновлення SiO2 і SiO вуглецем. Досягши температури в печі 1300...1400 °С перебігає твердофазна реакція між SiO2 і С, яка припиняється зі зникненням безпосереднього контакту між цими речовинами внаслідок утворення проміжного шару карбіду силіцію. Надалі процес відновлення здебільшого продовжується завдяки перенесенню SiO2 через газову фазу. Швидкість випаровування кремнезему залежить від модифікації SiO2, розміру зерен і температури, а адсорбція пари оксиду силіцію на зернах відновника — від активності, розміру площі поверхні і мікропористості вуглецевого матеріалу.
У ході процесу максимальна температура підвищення розвивається в електропровідному керні, що електропроводиться,який готують набиванням коксу з меншим опором, ніж шихта. У міру утворення навколо сердечника шарів графіту і SiC, що має низький електричний опір і високу теплопровідність, зона підвищеної температури розширяється в радіальному напрямі, що сприяє утворенню карбіду силіцію. Відбувається випаровування SiC, утвореного з високотемпературних зон, і його перенесення з подальшою конденсацією в холодніших зонах, що призводить до ущільнення шихти і зростання кристалів.
Після закінчення процесу утворюються продукти, які мають концентричні зони навколо керна і відрізняються за хімічним і фазовим складом (рис. 7.11). Найчистіший продукт, що характеризується стабільними абразивними і електричними показниками, ― карбід силіцію із зони 4, що містить близько 98 % SiC. Після охолодження піч розбирають і витягують блок карбіду силіцію, який після очищення дроблять і просіють з метою виділення фракцій порошку.
Склад карбідів силіцію, одержуваних в СРСР, наведено в табл. 7.20.
Одержаний таким чином карбід силіцію використовують здебільшого для виготовлення абразивних матеріалів. Для отримання чистих карбідів силіцію, крупних монокристалів, вусів, покриттів використовують інші методи. Карбід силіцію отримують прямим синтезом з елементів, при цьомуперебігає реакція
Si + С ® SiC.
Таблиця 7.20
Хімічний склад SiC
| Вид SiC | Уміст компонента, % | |||
| SiC | С | Si+SiO2 | Fe2O3 | |
| Чорний Зелений Електротехнічний | 98,0...99,0 98,0...99,5 98,0...99,0 | 0,1...0,3 0,1...0,3 0,1...0,3 | 0,2...2,0 0,2...1,2 0,1...2,0 | 0,1...0,3 0,05...0,2 0,1...0,3 |
Процес можна здійснювати за допомогою твердофазної взаємодії силіцію з вуглецем за температури 1150...1800 °С. При цьому кількість утворюваного SiC збільшується і удосконалюється його структура з підвищенням температури. За температур, що перевищують температуру плавлення силіцію, і до 2000 °С, утворюється b-SiC з досконалою структурою, чому сприяє висока рухливість атомів і висока розчинність вуглецю в рідкому силіції. За температури понад 2000 °С разом з b-SiC утворюється a-SiC.
Тепер цей метод застосовують найчастіше для силіціювання графіту і реакційного спікання карбідосиліцієвих матеріалів.
Карбід силіцію можна синтезувати з елементів також плазмохімічним методом. При цьому як вихідну сировину використовують як тверді, так і газоподібні компоненти. У першому випадку із силіцію і графіту формується електрод, який служить катодом, а анодом є три мідні водоохолоджувальні секції. З виникненням дугової плазми синтезується продукт, що містить близько 40% SiC. Частинки продукту, що відносяться транспортувальним газом, мають розмір до 8 мкм.
Перспективнішим є використання як вихідних компонентів газових сумішей, що складаються з галогенідів силіцію і вуглецевмісних газів. У цьому разі SiC синтезується в плазмовому струмені з газової фази.
Для отримання полі- і монокристалів карбіду силіцію застосовують методкристалізації з розчинів-розплавів. Так, наприклад, полікристалічні зразки SiC можна одержувати кристалізацією його з розплавів хрому за температури 1650... 1900 °С на приманці внаслідок синхронного переміщення зі швидкістю близько 3 мм за день кільцевого індукційного нагрівника. Рушійною силою процесу в цьому випадку є температурний градієнт, перпендикулярний до площини розплавленої зони.
Для отримання кристалів SiC високої чистоти, а також високощільних покриттів застосовують осадження з газової фази. При цьому процес здійснюють газофазним синтезом з летких галогенідів силіцію і вуглеводнів або термічною дисоціацією газоподібних силіцієорганічних сполук. Таким чином можна одержувати монокристали напівпровідників, щільні захисні покриття на металах, тугоплавких сполуках і графіті, високоміцні вуса і волокна для формування композиційних матеріалів.
Для отримання SiC розкладанням метилтрихлорсилану процес провадять обов’язково за наявності водню. Карбід силіцію може утворюватися за такими реакціями:
CH2SiCl3 ® CH2SiCl2 + Cl;
CH2SiCl2 ® CH2SiCl + Cl;
С1 + Н2 ® НС1 + Н;
СН2SiС1 ® СН2 + SiС1;
SiС12 +Н2 ®Si + НС1;
СН2 ® С + Н2;
Si + С ®SiС.
Таким чином, водень є активним компонентом проміжних стадій утворення карбіду силіцію, а також зменшує або повністю запобігає сажоутворенню.
Під час проведення процесу за температури, нижчої за 1450 °С, утворюються щільні полікристалічні осади, а швидкість утворення SiC визначається швидкістю хімічної реакції. За температури, вищої за 1600 °С, процес лімітується дифузійним надходженням реагентів до нагрітої підкладки. У цих умовах ростуть монокристали. Інтервал температур 1450...1600 °С проміжний. Якість продукту і швидкість його осадження можна точно регулювати, змінюючи параметри процесу – температуру, тиск, концентрацію компонентів, швидкість газового потоку. У цьому разі вплив цих параметрів подібний до впливу на процес отримання з газової фази інших карбідів.
Карбід бору. У системі В — С є два карбіди — В4С і В13С2. З них ширшого практичного застосування набув В4С. Цей карбід характеризується наявністю сильних ковалентних зв’язків між атомами вуглецю і бору і низькою концентрацією нелокалізованих електронів. Тому він має відносно високу хімічну тривкість, майже не розкладається мінеральними кислотами і їх сумішами. Гратки карбіду бору В4С характеризуються лінійним ланцюжком — С — С — С —, тому він є дірчастим напів-
провідником. Деякі властивості карбіду бору В4С наведено нижче (табл. 7.21)
Таблиця 7.21
Властивості карбіду бору
| Властивість | Значення |
| Щільність, г/см3 | 2,52±0,01 |
| Температура плавлення, °С | |
| Мікротвердість, ГПа | 49,5 |
| Абразивна здатність, ум. од. | 0,40...0,42 |
| Межа міцності на стиснення при 20 °С, ГПа | 2,1 |
| Температура кипіння, оС | |
| Ентропія при 25 °С, Дж/(кг. К) | |
| Теплота утворення з елементів, Дж/моль | |
| Теплопровідність (Вт/(м . К) За температури: 100 °С при 500 °C | 12 1... 67 75... 48 |
Питомий електроопір, 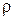 .108, (Ом. М)
за температури:
20 °C
100°С
500 °C .108, (Ом. М)
за температури:
20 °C
100°С
500 °C
|
Карбід бору застосовують у різних галузях техніки як у вигляді порошку, так і у вигляді спечених або литих деталей. Завдяки високій абразивній здатності його використовують для шліфування і полірування твердих матеріалів, заточування і доведення твердосплавних пластин для різання. У вигляді виробів з карбіду бору і зв’язуючого цей матеріал застосовують для виготовлення шліфувальних і відрізних кругів, різальних елементів бурових коронок, інструментів для обробки твердих сплавів. Специфічні електрофізичні властивості дозволяють використовувати його як високоомні опори, напівпровідникові термопари, поглиначі нейтронів у ядерних реакторах, ртутні випрямлячі і т. ін.
Високі зносостійкість і хімічна стійкість визначають застосування
карбіду бору у складі жароміцних і жаростійких матеріалів, хімічного посуду, а також матеріалів, схильних до підвищеного зносу.
Карбід бору можна одержувати декількома методами:
1) прямим синтезом з елементів;
2) відновленням борного ангідриду вуглецем;
3) магнієтермічним відновленням борного ангідриду за наявності вуглецю;
4) відновленням хлориду бору воднем за наявності вуглецю;
5) осадженням з газової фази.
Метод синтезу з елементів. Цей метод незнаходить широкого промислового застосування, проте його часто використовують у дослідницькій практиці для розроблення нових матеріалів. Варіанти отримання В4С відповідно до цього методу відрізняються апаратурним оформленням. Так, карбід бору може бути одержаний нагріванням суміші бору і сажі за температури вищої за 1600 °С у печах Таммана. Механізм утворення карбіду в цьому разі полягає в дифузії бору у вуглець. Коефіцієнт дифузії бору у вуглець D =3,02 ехр (–28625/ Т) — значно більший, ніж коефіцієнт дифузії вуглецю в бор, не зважаючи на те, що радіус атома бору більший від радіуса атома вуглецю. Визначальний в цьому разі менший потенціал іонізації атомів бору (13,25 . 10-19 Дж) порівняно з потенціалом іонізації атомів вуглецю (18,24 . 10-19 Дж).
Одержаний таким чином карбід має відносно високий ступінь чистоти, але високу вартість, тому виробництво його цим способом економічно нерентабельне.
Синтезувати карбід бору з елементів можна також плазмохімічним методом. Його сутність: порошок бору вдувають в аргоноводневу плазму разом з пропанбутановою сумішшю. У струмені плазми суміш пропану і бутану піддається піролізу з утворенням вуглецю, який, взає-
модіючи з бором, утворює карбід бору, розміри частинок якого 0,1...0,5 мкм.
Для отримання карбіду бору можливе також застосування методу СВС, суть якого стосовно отримання карбідів було розглянуто вище. Із суміші бору і вуглецю, узятих в стехіометричних співвідношеннях, синтезується карбід бору внаслідок перебігу екзотермічної реакції горіння вуглецю в бору. Процес провадять у вакуумі.
Перспективним є метод отримання карбіду бору, який суміщує його синтез і процес формування виробів. Для цієї мети застосовують гаряче пресування вихідної суміші бору і вуглецю за температури 2100...2400 °С у графітових прес-формах, що служать одночасно нагрівальним елементом. Перевага методу гарячого пресування ― унаслідок поєднання процесу синтезу із спіканням виходять вироби з карбіду бору з пористістю до 2...3 %.
Метод відновлення борного ангідриду вуглецем. Найширшого застосування цей метод набув у промисловій практиці. Як вихідні матеріали можна використовувати борний ангідрид або борну кислоту (як джерело бору) і нафтовий кокс або сажу. Використання сажі, яка має високу реакційну здатність, дозволяє проводити процес за відносно низької температури (1900...2000 °С) і високої швидкості. Можливе застосування декількох варіантів отримання карбіду, що розрізняються типом використовуваних для цього печей. Застосовують електродугові печі, кернові або безкернові електричні печі опору, печі опору з графітною трубкою. За одним з варіантів (рис.7.13) як вихідну сировину використовують борну кислоту НзВОз і нафтовий кокс, які після змішування брикетують і подають у піч. Разом з ними як компоненти для виплавки В4С застосовують також оборотний спек ― продукт сплаву борної кислоти з нафтовим коксом, утвореним у процесі плавки, і відходами з копра. Відходи з копра — це спек шихти, відібраний з поверхні блоків карбіду бору під час їх очищення.
Процес провадять у дугових електричних печах способом «на блок» за активної потужності 600...900 кВт із зануреними в шихту електродами. При цьому карбід бору утворюється за сумарною реакцією
4НзВОз + 4С ® В4С + ЗСО2 + 6Н2О.
Якщо як вихідну шихту використовують зневоднену за температури 800 °С суміш борної кислоти і сажі у вигляді губки, процес перебігає за реакцією
2В2О3 + 7С ® В4С+6СО
за дві стадії:
В2О3 + ЗСО = 2В + ЗСО2; 4В + С = В4С.
Після закінчення процесу нарощування блоку його охолоджують, очищають від спека, подрібнюють і розмелюють відповідно до призначення і вимог до продукту.
За іншим варіантом як вихідну сировину використовують шихту з борної кислоти і сажі, зневоднену за нагрівання до температури 800 °С. Борний ангідрид при цьому розплавляється, утворюючи губку борного ангідриду, добре перемішаного із сажею. Для отримання карбіду бору в кернових і безкернових печах використовують три температурні зони:
.

Рис.7.13. Технологічна схема виробництва карбіду бору плавкою в дугових печах
1 ) центральну зтемпературою 2500...2600 °С, у якій завершується
утворення карбіду; 2 ) проміжну, яка внаслідок нижчої температури заповнена сумішшю недовідновленого борного ангідриду, карбіду бору і неикористаної сажі; 3 ) зовнішню, заповнену шихтою, що не прореагувала.
Основний продукт реакції ― продукт першої зони, а матеріали другої і третьої зон використовують як поворотні.
Карбід бору, одержуваний в печах Таммана, характеризується переважно стехіометричним складом, хорошою технологічністю утворюваного продукту. Проте цей метод малопродуктивний, тому не знаходить широкого промислового застосування.
Магнієтермічний метод отримання карбіду бору. Вінпридатний для отримання продукту стехіометричного складу. В основі його лежить реакція
2B2O3 + 6Mg + З = B4C + MgO.
Процес провадять через нагрівання шихти, що складається з вихідних компонентів, узятих у визначених співвідношеннях, в електричних печах опору з графітовою трубою за температури 1800 °С. Отриманий продукт для видалення оксиду магнію обробляють сірчаною кислотою, а для очищення від летких домішок — прожарюють у вакуумних печах за температури 1800 °С. Широкого застосування метод не набув.
Метод відновлення хлориду бору воднем за наявності вуглецю. Цей метод застосовують для осадження карбіду бору з газової фази. Процес перебігає за реакцією
4ВС1з + 6Н2 + С = В4С + 12НС1.
Одним з варіантів його здійснення може бути нагрівання за температури 600 °С шихти, що складається з борного ангідриду і надлишку сажі, в струмі хлору. При цьому утворюється суміш ВС1з і С, яка за наявності водню взаємодіє з ним з осадженням на нагрітій підкладці шару карбіду бору.
Метод осадження з газової фази. Застосовують для отримання монокристалів у вигляді пластин, вусів і покриттів з карбіду бору. В основі методу ― реакція
4ВС1з + СС14 + 8Н2 = В4С + 16НС1.
Процес провадять у трубчастій печі за температури 1550...1650 оС, використовуючи як вихідні матеріали суміш ВС1з і СС14 з надлишком водню. У цьому разі утворюється карбід бору у вигляді монокристальних пластин і голок, розмір яких залежить від тривалості процесу. Так, наприклад, за 4...5 год утворюються монокристали завдовжки 3...4 мм, уміст домішок в яких не перевищує  .
.
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 703; Нарушение авторских прав?; Мы поможем в написании вашей работы!