
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Отримання порошків боридів
|
|
|
|
Умови осадження нітридів з газової фази
| Нітрид | Склад газової фази | Температура процесу, оС |
| TiN | TiCl4: 3N2: H2 = 1: 3: 2 | 1100...1700 |
| ZrN | ZrCl4: 3N2: H2 = 1: 3: 2 | 1100...2700 |
| ZrN | ZrCl4: N2 = 1: 2 | 2800...3000 |
| HfN | HfCl4: 3N2: H2 = 1: 3: 2 | 1100...2700 |
| VN | VCl4: 3N2: H2 = 1: 3: 2 | 1100...1600 |
| NaN | Ta Cl 5: N2 = 1: 2 | 2400...2600 |
Існує декілька методів отримання боридів:
1) прямий синтез з елементів;
2) високотемпературний синтез, що самопоширюється (метод СВС);
3) металотермічне відновлення;
4) відновлення оксидів металів бором з одночасним боруванням;
5) електроліз розплавлених середовищ;
6) осадження з газової фази;
7) відновлення оксидів металів вуглецем карбіду бору (борокарбідний метод);
8) сумісне відновлення сумішей оксидів металів і борного ангідриду вуглецем (вуглетермічний метод);
9) метод плазмохімічного синтезу.
Із названих методів отримання бориду найширшого промислового застосування набувають борокарбідний і вуглетермічний. Перспективні ― плазмохімічний метод і метод СВС.
Отримання бориду прямим синтезом з елементів. Синтез провадять із забезпеченням умов проходження реакції за схемою
Ме + В ® МеB,
яка може здійснюватися як в рідкій фазі (плавленням шихти в дугових або індукційних печах), так і в твердому стані (спіканням цієї шихти в печах опору різного типу).
В основі процесу утворення бориду в цьому випадку лежить дифузія бору в метал. Реальна швидкість дифузії значною мірою залежить від кінетичних чинників, розміру частинок металу і бору, якості приготування шихти відносно рівномірності розподілу компонентів у ній, наявності та виду газового середовища в реакційному просторі, наявності на поверхні частинок металу оксидів. Тому оптимальні режими отримання бориду в кожному конкретному випадку потрібно встановлювати експериментально залежно від властивостей вихідних матеріалів і умов проведення синтезу. У разі отримання бориду синтезом з елементів без плавлення оптимальні температури становлять 1300...2500 °С. При цьому як середовище можна використовувати вакуум, якщо процес відбувається за низьких температур, або інертні гази — за високих.
Зручним варіантом методу отримання бориду синтезом з елементів є спікання сумішей гарячим пресуванням, яке дає можливість одержувати борид у вигляді виробів або напівфабрикатів кінцевої щільності і розмірів. Проте іноді отримання матеріалів з максимальною щільністю ускладнено, оскільки утворення бориду супроводжується тиском кристалізації і відособленням частинок нової фази.
Щільніші вироби отримують подрібненням одержаних заготовок, повторним пресуванням і спіканням бориду, що вже утворився.
Різновидом методу синтезу може бути взаємодія бору не з чистим металом, а з його гідридами, нітридами або сульфідами. Так, наприклад, застосування як вихідних матеріалів гідридів металів сприяє тому, що атоми металів, утворені в результаті їх дисоціації, мають підвищену активність, а водень, що виділяється, захищає реакційну масу від окиснення. Проте цей варіант технології потребує дотримання підвищених заходів безпеки у зв’язку з можливістю утворення вибухонебезпечних сумішей газів.
Недолік методу синтезу бориду з елементів ― отримати чистий борид можна тільки, використовуючи чисті вихідні компоненти, що досить дорого, особливо отримати чистий бор. Висока вартість і в деяких випадках дефіцитність вихідних матеріалів збільшує вартість і ускладнює виробництво бориду за цим методом, роблячи його нерентабельним.
Ці недоліки можна усунути, якщо для отримання бориду використати метод СВС, суть якого розкрито за допомогою методів отримання карбідів і нітридів. Система метал — бор належать до типу «безгазових систем» з усіма властивими їм закономірностями. Як і в разі отримання карбідів, на отримання бориду методом СВС істотно впливають співвідношення вихідних компонентів, розміри частинок металу і бору, щільність брикетів вихідних сумішей. Іноді для зменшення виділення теплоти і підтримання температури процесу в оптимальних межах до складу вихідної шихти вводять «інертну» речовину, якою може бути порошок готового бориду.
Режими синтезу і склади деяких боридів, одержаних методом СВС, наведено в табл. 7.11.
Перевага методу СВС порівняно з іншими методами прямого синтезу бориду полягає у високій швидкості, простоті процесу, малій енергоємності, можливості проведення синтезу в захисному середовищі. Усе це забезпечує високу рентабельність процесу і якість одержаного продукту.
Таблиця 7.11
Режими синтезу і деякі властивості бориду, одержаного методом СВС
| Борид | Адіабатична температура, °С | Уміст, % | |||
| Чиста суміш | Суміш з інертною домішкою | Ме | Взаг | Ввільн | |
| TiB2 | 69,20 | 31,30 | |||
| ZrB2 | 2117...2667 | 79,80 | 19,05 | 0,10 | |
| HfB2 | ― | 89,15 | 10,70 | 0,12 | |
| NbB2 | 1717...1917 | 81,80 | 18,45 | 0,17 |
Борид отримують металотермічним відновленням тоді, коли як вихідні матеріали використовують оксиди металів, борний ангідрид, а як відновники ― алюміній, магній, кальцій або силіцій. Реакція перебігає за схемою
MeO + B2O3 + Al(Mg, Ca, Si) ® MeB + Al(Mg, Ca, Si) О4.
Повноту і швидкість проходження процесу оцінюють за значенням термічності — відношенням теплового ефекту реакції до суми мас реагувальних речовин (маси шихти). Мінімальні значення термічності майже для всіх відновників мають становити 25 Дж/кг шихти.
У разі металотермічного відновлення процес утворення бориду відбувається через окиснювально-відновні реакції, у яких початкові речовини завжди в твердому стані, а кінцеві продукти часто оплавлені спеками. Це особливо характерно для випадку використання як відновника алюмінію у зв’язку з високими температурами процесу. Для виділення утвореного бориду спек подрібнюють і одержаний продукт розсіюють для відділення грубозернистого бориду від дрібних частинок оксиду алюмінію.
Найдоцільніше отримувати борид цим методом ― відновленням оксидів магнієм і кальцієм. Із хімічного погляду процес утворення бориду відбувається так, що спочатку магній відновлює борний ангідрид до бору, який також відновлює оксиди металів з утворенням бориду. Іноді як джерело бору застосовують борну кислоту, яка в суміші з оксидом металу зневоднюється через повільне нагрівання до температури 800 °С. Одержану при цьому губку подрібнюють, просіюють, змішують з пот-рібною кількістю магнію і відновлюють за температури, вказаної в
табл. 7.12. При цьому борид, близький за складом до стехіометричного, отримують у разі введення у вихідну шихту подвійного надлишку борного ангідриду і деякого надлишку магнію.
Недолік металотермічного відновлення ― складність розділення продуктів, можливість утворення бориду металів-відновників.
Таблиця 7.12
Умови отримання боридів металотермічним методом
| Борид | Склад шихти, моль | Температура, оС | Склад бориду, % | ||
| Me | B | Me+B | |||
| VB | V2O5 + 3B2O3+ 12Mg | 82,8 | 17,0 | 99,8 | |
| VB2 | V2O5 + 4B2O3+ 15Mg | 70,8 | 29,0 | 99,8 | |
| NbB2 | Nb2O5+ 4B2O3+ 17Mg | 80,9 | 19,0 | 99,9 | |
| TaB | Ta2O5 + 3B2O3 + 12Mg | 94,2 | 5,6 | 99,8 | |
| TaB2 | Ta2O5 + 4B2O3+ 17Mg | 89,9 | 10,0 | 99,9 | |
| CrB2 | Cr2O3 + 3B 2O 3+ 12Mg | 71,0 | 28,9 | 99,9 | |
| Mo2B2 | 2MoO3+4,5B2O3+ 13,5Mg + 5Mg | 79,6 | 20,3 | 99,9 | |
| W2B5 | 2WO3+4,5B2O3 + 13,5Mg + 5Mg | 88,0 | 11,8 | 99,8 |
Отримання бориду відновленням оксидів металів бором з одночасним боруванням. Процес перебігає за реакцією
2МeO + 4B ® 2MeB + B2O2.
Для здійснення процесу шихту, що складається з відповідного оксиду металу і бору, узятих в стехіометричних співвідношеннях, пресують в брикети під тиском 50...100 МПа, завантажують у контейнер з ідентичного бориду і поміщають у вакуумну піч. Процес відновлення і борування проводять під тиском 10...100 МПа. Для інтенсифікації видален-
ня утворюваного газоподібного В2О3 і значної частини летких домішок, що містяться у вихідних речовинах, доцільно застосовувати ва-куумні печі. Крім того, це дає змогу отримувати продукти високого ступеня чистоти навіть у разі використання промислового магнієтермічного бору, що містить домішки магнію у вигляді бориду. Під час дисоціації останнього магній, що має за температури процесу високу пружність пари, випаровується з подальшим видаленням з реакційного простору.
Більшість боридів одержують за температури, коли леткість В2О2 висока, а леткість В ще незначна. Температурні режими отримання бориду цим методом наведено в табл. 7.13.
Наведені в таблиці дані показують, що вакуумні печі дозволяють одержувати бориди високого ступеня чистоти, за складом близькі до стехіометричного (Me + В» 100 %).
Недоліком методу відновлення оксидів металів бором є відносна складність устаткування і мала продуктивність, що призводять до високої вартості бориду. Тому цей метод застосовують для отримання бориду, використовуваного у виробах спеціального призначення.
Таблиця 7.13
Режими отримання боридів відновленням оксидів металів бором
у вакуумі за часу витримування 60...150 хв
| Борид | Температура, оС | Склад, % | |
| Ме | В | ||
| TiB2 | 69,0 | 30,8 | |
| ZrB2 | 80,3 | 19,1 | |
| HfB2 | 89,0 | 10,9 | |
| VB2 | 80,2 | 19,8 | |
| NbB2 | 80,2 | 19,0 | |
| TaB2 | 88,8 | 10,5 | |
| CrB2 | 70,6 | 29,3 |
Отримання боридів електролізом розплавлених середовищ. Бориди тугоплавких металів у вигляді дисперсних, добре закристалізованих осадів, можна одержати електролізом розплавів, що складаються із сумішей лужних і лужноземельних металів з їх оксидами.
Як флюси використовують фториди магнію, кальцію або літію. Процес провадять у спеціальних електролізерах, у яких анодом служить графітний тигель, а катодом — графітний або металевий стрижень за напруги 5 В і струму 20 А.
Сутність процесу така. Під час електролізу на катоді виділяється елементарний бор, утворюваний внаслідок перебігу реакції відновлення ангідриду бору лужним металом, що виникає в результаті електролізу:
2В2O3 + ЗNа ® ЗNаВO2 + В.
Разом з цим перебігає процес відновлення оксиду тугоплавкого металу і взаємодія відновленого металу з бором, внаслідок чого утворюється борид. Режими отримання боридів і їх складів наведено в табл. 7.14. Хімічний склад одержаних у результаті електролізу боридів можна регулювати, змінюючи склад умісту ванни. При цьому найбільше впливає кількість оксидів металів.
Метод отримання боридів електролізом відрізняється простотою технології, низькими температурами, доступністю вихідних речовин. Проте цим методом важко одержати продукти певного складу. Крім того, бориди в цьому випадку містить домішки вуглецю і металів-відновників. Процеси виділення боридів з катодного осаду і їх очищення передбачав деякі спеціальні операції. Усе це знижує економічність методу й обмежує його застосування в промисловості.
Отримання боридів осадженням з газової фази. Метод аналогічний методу отримання карбідів і нітридів розкладанням галогенідів металів на підігрітій основі за наявності боровмісних газоподібних речовин. Боровмісними компонентами можуть бути бромід або хлорид бору, які відновлюються за реакцією
МеС1 х + ВС1з + Н2 ® МеВ2 + НС1.
На процес формування осадів впливають температура, швидкість проходження реагентів через реакційний простір, а також співвідношення водню, хлориду металу і хлориду бору. Так, наприклад, оптимальними умовами отримання бориду титану є температура близько 1400 °С і молярне співвідношення Н2/(ТiС14+ВС13) £ 30. За великих співвідношень кристалічність осадів зменшується і в них з’являється аморфний борид.
На склад осадів, їх пористість і орієнтацію кристалів також впливають умови процесу. Так, збільшуючи або зменшуючи подачу водню, можна одержувати пористі або кристалічні осади з різним ступенем орієнтації. Зі збільшенням тиску утворюються більш дрібнозернисті осади, а за підвищення температури в осадах зменшується вміст металу.
Метод осадження боридів з газової фази доцільно використовувати для отримання боридних покриттів, монокристалів, а також виробів складної форми.
Отримання боридів відновленням оксидів металів вуглецем карбіду бору (борокарбідний метод). Метод ― один з основних промислових методів отримання боридів перехідних металів. В основі цього методу лежать реакції:
Таблиця 7.14
Умови отримання боридів електролізом розплавлених середовищ
| Борид | Склад вмісту ванни, моль | Темпера- тура, °С | Уміст, % | |
| Ме | В | |||
| TiB2 | 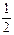 TiО2+2B2O3+MgO+MgF2 TiО2+2B2O3+MgO+MgF2
| 68,5...69,1 | 68,5...69,1 | |
| ZrB2 |  ZrO2+2B2O3+MgO+MgF2 ZrO2+2B2O3+MgO+MgF2
 ZrO2+2B2O3+CaO+CaF2 ZrO2+2B2O3+CaO+CaF2
 ZrO2+2B2O3+CaO+CaF2 ZrO2+2B2O3+CaO+CaF2
| 81,0...86,3 | 13,8...19,0 | |
| VВ2 |  V2O5+2B2O3+MgO(СаО)+
+MgF2(СаF2) V2O5+2B2O3+MgO(СаО)+
+MgF2(СаF2)
| 69,5...70,0 | 29,4...30,2 | |
| NbB2 |  Nb2O5+2В20з + СаО + СаF2 Nb2O5+2В20з + СаО + СаF2
| 80,0...81,7 | 18,0...18,2 | |
| TaB2 |  Tа2О5 + 2B2О3 + MgO +
+ MgF2 Tа2О5 + 2B2О3 + MgO +
+ MgF2 
| 89,1...89,4 | 10,3...10,7 | |
| CrB2 | 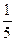 Cr2O3 + 2B2O3 + CaO + CaF2 Cr2O3 + 2B2O3 + CaO + CaF2
| 87,4...87,6 | 11,8...12,1 | |
| Мo2В5 | 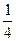 МоОз + 2В2Оз + NаF МоОз + 2В2Оз + NаF
| 93,3...94,0 | 5,32...5,66 | |
| WВ |  WОз + 2В20з . Nа20 + NаF WОз + 2В20з . Nа20 + NаF
| 93,9...94,5 | 5,1...5,4 |
МеО + В4С + С ® Ме x В у + СО;
Ме (МеН, МеС) + В4С + B2О3 ®МеB + СО.
Технологічна схема промислового отримання боридів включає операції приготування вихідних матеріалів і шихти з них, брикетування шихти, нагрівання і подальшу переробку одержаного продукту шляхом помелу і просіву.
Як вихідні матеріали для отримання боридів використовують метали або їх оксиди залежно від вибраної схеми виробництва, карбід бору – за ГОСТ 5744 – 85, сажу мазки ПМ-50 – за ГОСТ 7885 – 86 і борний ангідрид.
Оксиди металів з метою видалення вологи і домішок органічного походження прожарюють за температури близько 800 °С протягом 2 год. Карбід бору сушать за температури 70...80 °С протягом 4 год. У разі використання грубозернистого карбіду бору його розмелюють у кульових млинах до розміру частинок менше за 50 мкм. Сажу прожарюють за температури 400 °С протягом 2 год. Якщо використовують борний ангідрид для промислових партій, його також розмелюють у кульових млинах до розміру частинок менше за 5 мкм. При цьому тривалість помелу може досягати 15 год.
Складаючи шихту, слід враховувати, що в промисловому карбіді бору співвідношення бору і вуглецю (у відсотках) може змінюватися, найчастіше в бік збільшення вмісту вуглецю (В + С = 100). Тому, якщо вміст (у відсотках) карбіду бору відрізняється від теоретичного (78,3В + 21,7С), то виконують відповідний перерахунок кількості сажі, що додається в шихту.
Так, наприклад, якщо за стехіометричною реакцією
МеО + В4С + С = МеB + СО
потрібен т (г) МеО, п (г) В4Сі р (г) С, а фактично карбід бору містить
q % В і d % С, то для забезпечення вмісту в шихті необхідної кількості бору п .78,3/100 необхідно 78,3 п/q (г) карбіду. В ньому міститься 0,783 пd/q (г) вуглецю, а оскільки для реакції потрібно всього п . 21,7/100 +p2 г вуглецю, то домішка вуглецю у вигляді сажі має становити п . 21,7/100+ + р - 0,783 пd/q (г). Таким чином, склад шихти має бути таким:
оксид металу – м (г); карбід бору – 78,3 п1q (г); сажа – 21,7/100 + р –
– 0,783 nd/q (г).
Підготовлені таким чином компоненти змішують у кульовому млині протягом 6...8 год, якщо завантаження барабана становить 0,3...0,4 об’єму, а відношення маси шихти до маси куль – 1: 3. Після змішування шихту для руйнування конгломератів і підвищення однорідності протирають через сито.
Для зменшення об’єму шихти з метою підвищення продуктивності та збільшення площі контакту між частинками суміш брикетують за тиску 50...100 МПа або щільно набивають у контейнери з графіту.
Процес отримання боридів можна здійснювати у вакуумних печах з графітовим або металевим нагрівником чи в печах опору з графітовою трубою (печі Таммана) в середовищі водню або конвертованого газу.
У разі проведення процесу у вакуумі відбувається неперервне видалення оксиду вуглецю і зміщення рівноваги реакції у бік утворення бориду. Крім того, проведення реакції у вакуумі запобігає азотуванню і окисненню одержуваного бориду.
Процес отримання боридів провадять за початкового тиску в печі 1,5...2,0 Па і температури 1500...1800 °С. Утворення боридів проходить через декілька стадій, які відповідають утворенню проміжних оксидів металів. Так, наприклад, ТiO2 відновлюється до нижчих оксидів Ti2O3 і TiO вуглецем сажі, а потім ТiO відновлюється карбідом бору до бориду титану, що зумовлено більшою термодинамічною стійкістю ТiO порівняно з ТiO2 і Ti2Оз.
Реакція утворення бориду супроводжується виділенням теплоти. Константа рівноваги реакції утворення бориду і тиск пари оксиду вуглецю (II) з підвищенням температури збільшуються, що спричиняє зміщення рівноваги в бік утворення бориду. У зв’язку з цим температуру процесу можна зменшити, знижуючи тиск в реакційному просторі. Так, наприклад, якщо утворення бориду цирконію в печі Таммана за звичного тиску водню відбувається за температури 2000 °С, то у вакуумній печі за інших рівних умов ― за температури 1600 °С.
Приклади режимів отримання боридів тугоплавких металів наведено в табл. 7.15. При цьому слід мати на увазі, що оптимальні температури і тривалість ізотермічної витримки необхідно уточнювати стосовно конкретних умов здійснення процесу. Температура і тривалість можуть змінюватися зі зміною маси завантажуваної шихти, робочого вакууму, об’єму робочого простору. Збільшення маси шихти і підвищення тиску зумовлюють потребу підвищення температури і тривалості нагрівання.
Для здійснення процесу в печах Таммана шихту готують аналогічно.
На склад і гомогенність одержуваного продукту впливають температура процесу, тривалість нагрівання до ізотермічної витримки. Крім того, можуть впливати також якість вихідної сировини та середовище нагрівання.
Таблиця 7.15
Режими отримання бориду у вакуумі борокарбідним методом
| Борид | Температура процесу, °С | Тривалість витримки, год | Уміст, % | å Me, B, C | |||
| Ме | B | С | |||||
| ТiВ2 | 1,0 | 68,20 | 31,02 | 0,02 | 99,24 | ||
| ZгВ2 | 1500...1600 | 0,5 | 80,72 | 19,20 | 0,01 | 99,93 | |
| VВ2 | 1400...1500 | 1,0 | 70,00 | 29,95 | 0,05 | 100,00 | |
| NbB2 | 1500...1600 | 1,0 | 80,36 | 18,90 | 0,09 | 99,35 | |
| ТаВ2 | 1400...1500 | 1,0 | 89,17 | 10,23 | 0,14 | 99,54 | |
| СгВ2 | 1400...1500 | 1,0 | 70,58 | 29,39 | 0,02 | 99,99 | |
| Мо2Вб | 1,0 | 77,15 | 22,63 | 0,09 | 99,87 | ||
| W2B5 | 1200...1300 | 1,0 | 87,00 | 12,90 | 0,10 | 100,00 |
Реакції відновлення оксидів металів і утворення бориду починаються для TiB2 за температури 1300 °С, для ZrB2 – 1500 °С, для VB2 і NbB2 – 1000 °С, для СгВ2 – 1100 °С і для W2B5 – 1300 °С, що узгоджується з термодинамічними характеристиками компонентів і реакцій утворення бориду за цією схемою. Подальше підвищення температури інтенсифікує процес і сприяє утворенню продукту, за складом близького до теоретичного.
Залежність хімічного складу одержуваного бориду від температури процесу зазвичай має вигляд, показаний на рис. 7.10.
Оптимальні температури отримання бориду в цьому випадку для титану, цирконію і ніобію є 1900°С, ванадію, хрому і вольфраму (W2B5) — 1800 °С, гафнію — 2000 °С. Тривалість ізотермічної витримки має становити не менше 60 хв.

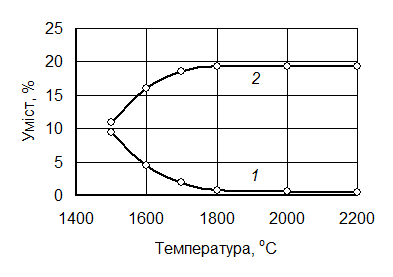
Рис. 7.10. Залежність хімічного складу бориду цирконію від температури процесу:
1 – Соб; 2 – В; 3 – Zr; 4 – å (Zr, B, Cоб)
Тривалість підвищення температури до оптимальної впливає на склад продуктів реакцій за тривалості ізотермічної витримки менше 60 хв. У разі ж триваліших термінів витримок швидкість нагрівання майже не впливає на склад одержуваного бориду.
Зі збільшенням тривалості витримки за оптимальних температур отримання бориду ступінь повноти проходження реакції підвищується і досягає максимуму за тривалості витримки 60 хв. При цьому утворюється бориди, за складом близькі до заданого. Подальше збільшення тривалості витримки зумовлює незначне підвищення вмісту вуглецю в одержуваних продуктах, а також зниження вмісту бору. Проте їх вміст відповідають допустимим значенням, визначеним стандартом.
Термодинамічні оцінки процесів отримання бориду дозволяють стверджувати, що, як і в разі отримання їх у вакуумі, відновлення оксидів і утворення TiB2, ZгВ2, HfB2 і NЬВ2 проходить через стадії утворення нижчих оксидів і нижчого бориду. Процес же відновлення оксидів ванадію, хрому і вольфраму й утворення їх бориду проходить через стадію утворення металу і нижчого бориду.
Із властивостей вихідних компонентів найістотніший вплив справляють властивості карбіду бору і сажі, що передусім пояснюється впливом розміру частинок і питомої поверхні В4С та сажі на швидкість і ступінь повноти перебігу реакцій утворення бориду.
Використання у складі шихти карбіду бору, розмір частинок яких становить 100...160 мкм, не дозволяє одержати продукт за складом близький до теоретичного, і в ньому завжди міститься 0,8...1,3 % вуглецю. Однак проведення процесу в аналогічних умовах, але з використанням карбіду бору, розмір частинок яких 40...80 мкм, призводить до утворення продукту заданого складу із вмістом вуглецю, не більшим за 0,3%. Останнє пояснюється підвищенням реакційної здатності карбіду бору внаслідок зменшення розміру частинок, що зумовлено збільшенням питомої поверхні і площі контакту з іншими компонентами шихти.
Аналогічно впливають властивості сажі на склад одержуваних продуктів. Так, наприклад, у разі отримання дибориду титану збільшення питомої поверхні сажі від 15 (марка ПМ-15) до 75 м2/г (марка ПМ-75) зумовлює зниження вмісту вуглецю в бориді з 0,8 до 0,2 % і збільшення вмісту å ( Ti, В, С) з 98,8 до 99,8 %.
Як середовище печі, у якій утворюється борид, можна використовувати водень і конвертований газ або ж проводити процес у «власному середовищі», тобто в середовищі газоподібних продуктів згоряння графітного оснащення з утворенням оксиду вуглецю (II). На отримання технічно чистих боридів середовище майже не впливає, зокрема на склад одержуваного матеріалу. Тільки, якщо процес відбувається у «власному середовищі», спостерігається підвищення вмісту вуглецю з 0,2 до 0,4 %.
Після нагрівання шихти за оптимальних умов одержаний продукт, що є спеченою губкою, мелють в кульових млинах і просіюють з виділенням заданої фракції порошку.
Отримання бориду сумісним відновленням сумішей оксидів металів і борного ангідриду вуглецем (вуглецевий метод). Цей метод ― один з основних, застосовуваний для виробництва бориду в промислових масштабах. Він грунтується на реакції
МеО + В2Оз + С ® МеxВу + СО
і відрізняється від борокарбідного тим, що як вихідну сировину можна використовувати дешевші матеріали (оксиди, борний ангідрид).
Вихідні компоненти, підготовані відповідним чином, змішують. При цьому кількість борного ангідриду, що вводиться до складу шихти, має перевищувати теоретично потрібну через високу його леткість за температур відновлення.
У промислових умовах процес зазвичай проводять у печах Таммана з використанням захисного середовища. На склад і властивості одержуваного бориду впливають температура, тривалість ізотермічної витримки, склад шихти і властивості вихідних компонентів, швидкість підвищення температури до досягнення температури ізотермічної витримки.
Характер впливу швидкості нагрівання, температури і тривалості ізотермічної витримки для отримання бориду карботермічним методом аналогічний впливу як і в разі отримання їх карбоборидним методом.
Оптимальні температури процесу отримання диборидів у цьому випадку такі: для титану, цирконію і ніобію – 1900 °С, гафнію – 2000 °С, ванадію і хрому – 1800 oС, вольфраму (W2B5) – двостадійне відновлення за температури 850 °С і витримка протягом 60 хв, а потім підвищення температури з максимальною швидкістю до 1600 °С. Тривалість ізотермічної витримки для отримання всіх боридів становить 60...120 хв.
На склад одержуваних боридів істотно впливає склад шихти. У разі використання шихт стехіометричного складу кінцевий продукт сильно забруднений вуглецем, що зумовлено високою леткістю борного ангідриду за температури відновлення. Щоб компенсувати втрати борного ангідриду через випаровування, у вихідну шихту потрібно вводити його надлишок. Оптимальні надлишки борного ангідриду такі: для отримання диборидів титану, цирконію, гафнію, ніобію—20...30%, диборидів ванадію, хрому і вольфраму (W2B5) —30...40 %. У цьому разі за оптимальної температури процесу швидкість відновлення оксидів металів і утворення боридів переважають над швидкістю випаровування борного ангідриду.
Подальше збільшення надлишку борного ангідриду в шихті понад оптимальне значення не сприяють прискоренню процесу, підвищенню ступеня перетворення вихідних компонентів на продукти реакції, а навпаки, спричиняють інтенсивне випаровування борного ангідриду, його плавлення і утворення склоподібної маси.
Застосування у складі шихти сажі малоактивних марок (ПМ-15, ПМ-30, а для бориду вольфраму і ПМ-50) не дозволяє одержувати бориди, що містять менше 1,0 % вуглецю, оскільки мала активність сажі призводить до переважання швидкості випаровування і випаровування борного ангідриду над швидкістю відновлення металів і утворення боридів. Використання сажі високоактивних марок (ПМ-75) зумовлює отримання боридів заданих складів із вмістом вуглецю до 0,3 %.
Окрім перерахованих методів бориди можна одержувати також методом плазмохімічного синтезу аналогічно отриманню нітридів і карбідів тугоплавких сполук.
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 948; Нарушение авторских прав?; Мы поможем в написании вашей работы!