
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типовые задачи
За 













 дача 1. Составить схему гальванической цепи для измерения стандартного электродного потенциала никелевого электрода и рассчитать величину ЭДС указанного гальванического элемента.
дача 1. Составить схему гальванической цепи для измерения стандартного электродного потенциала никелевого электрода и рассчитать величину ЭДС указанного гальванического элемента.
Решение:
Стандартные параметры, при которых определяются величины стандартных электродных потенциалов:
Р = 101,325 кПа (1 атм.); Т = 298К(250С); а катиона = 1 мольˑдм– 3
1) Схема стандартного никелевого электрода:
Ni/Ni2+; E0 (Ni/Ni2+) = – 0,25 B (см. Приложение 3.4.)
2) Схема стандартного водородного электрода:
(Pt)H2/H+; E0 (Н+/½Н2) = 0 B
P(H2) = 1атм
а(Н+) = 1 моль/дм– 3
3) Схема гальванической цепи:
Pt(H2) │ H+ ║ Ni2+│Ni
p(H2) = 1атм а(Н+) = 1моль/дм3
ЭДС = 0 – (– 0,25) = 0,25В
Ответ: ЭДС = 0,25В
Задача 2. Гальванический элемент состоит из стеклянного и насыщенного хлорсеребряного электродов. При 250С ЭДС составляет 0,036 В. Рассчитать потенциал стеклянного электрода, если для данной концентрации ионов водорода потенциал насыщенного хлорсеребряного электрода выше потенциала стеклянного электрода.
Решение:
1) Запишем схему гальванической цепи:
Стеклянный электрод │ Н+ ║ AgCl │ Ag
KCl (нас)
2) Выразим ЭДС гальванического элемента и рассчитаем потенциал стеклянного электрода:
ЭДС = Е (х/с) – Е (ст.)
Е (ст.) = Е (х/с) – ЭДС
Е (х/с) = 0,222 В
Е (ст.) = 0,222 – 0,036 = 0,186 В
Ответ: Е (ст.) = 0,186 В
Задача 3. Гальванический элемент состоит из водородного электрода, опущенного в мочу с рН 5,3 и насыщенного хлорсеребряного электрода. Определить величину ЭДС при 250С.
Решение:
1) Рассчитаем потенциалы водородного электрода:
Е (Н+/½Н2) = Е0 (Н+/½Н2) + 0,059 · lgа(H+)
Так как Е0 (Н+/½Н2) = 0 В
рН = – lg a(H+)
Уравнение примет вид:
Е (Н+/½Н2) = – 0,059 · рН
Е (Н+/½Н2) = – 0,059 · 5,3= – 0,314 В
2) Сравним потенциалы водородного и насыщенного хлорсеребряного электродов:
Е (Н+/½Н2) = – 0,314 В
Е (х/с) = 0,222 В.
Е (х/с) > Е (Н+/½Н2)
3) Составим схему гальванической цепи и рассчитаем ЭДС:
(Pt)H2 │ H+ ║ AgC1 │ Ag
(кровь) КС1(нас)
ЭДС = Е (х/с) – Е (Н+/½Н2)
ЭДС = 0,222 – (– 0,314) = 0,536 В
Ответ: 0,536 В
Задача 4. Как изменится потенциал медного электрода, если раствор сульфата меди в жидкой фазе этого электрода разбавить в 5 раз? Е0 (Сu2+/Cu) = 0,34 B (см. Приложение 3.4.).
Решение:
1)Выразим потенциал медного электрода до разбавления:
Е1 (Сu2+/Cu) = E0 (Сu2+/Cu) + 0,059/2· lg а (Cu2+)
2)Выразим потенциал медного электрода после разбавления:
Е2 (Сu2+/Cu) = E0 (Сu2+/Cu) + 0,059/2· lg a (Cu2+) / 5
3)Определим разность потенциалов медного электрода до и после разбавления:
ΔЕ = Е1 – Е2
ΔЕ = Е0 (Сu2+/Cu) + 0,059/2·lg a (Cu2+) – E0 (Сu2+/Cu) + 0,059/2· lg a (Cu2+) / 5
ΔЕ = 0,0295 (lg a (Cu2+) – lg a (Cu2+) / 5)
ΔЕ = 0,0295 (lg a (Cu2+) – lg a (Cu2+) + lg 5); т.к. lg5 = 0,7
ΔЕ = 0,0295 · 0,7 = 0,02 В
Ответ: 0,02 В
Тестовые задания для самоконтроля
Выберите правильный вариант ответа
01. УКАЖИТЕ СХЕМУ ХЛОРСЕРЕБРЯНОГО ЭЛЕКТРОДА
1) КСIнасыщ., АgОН |Аg
2) КBr, АgОН |Аg
3) Аg| АgCl, КСIнасыщ.
4) Аg| АgNO3, КNO3насыщ.
02. НА ГРАНИЦЕ РАЗДЕЛА МЕТАЛЛ – РАСТВОР СОЛИ МЕТАЛЛА ВОЗНИКАЕТ ___________ ПОТЕНЦИАЛ
1) контактный
2) диффузный
3) мембранный
4) электродный
03. УРАВНЕНИЕ НЕРНСТА ИМЕЕТ ВИД
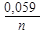
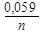 1) E = E0 ± ln aкат., ан. 2) E = E0 ±
1) E = E0 ± ln aкат., ан. 2) E = E0 ± 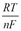 lg aкат., ан. 3)E = E0 ± lg a(кат./ан.)
lg aкат., ан. 3)E = E0 ± lg a(кат./ан.)
04. ДИФФЕРЕНЦИАЛЬНАЯ КРИВАЯ ПОТЕНЦИОМЕТРИЧЕСКОГО ТИТРОВАНИЯ ИМЕЕТ ВИД
05. ВЕЛИЧИНА СТАНДАРТНОГО ЭЛЕКТРОДНОГО ПОТЕНЦИАЛА НЕ ЗАВИСИТ ОТ
1) концентрации вещества в растворе
2) природы электрода
3) величины ЭДС гальванического элемента
4) рН раствора
06. ПРИНЦИП ПОТЕНЦИОМЕТРИЧЕСКОГО ОПРЕДЕЛЕНИЯ рН ЗАКЛЮЧАЕТСЯ В
1) измерении ЭДС цепи, состоящей из электродов определения и сравнения
2) измерении потенциала электрода сравнения
3) измерении электрической проводимости исследуемого раствора
4) измерении потенциала хлорсеребряного электрода
07. НАЙДИТЕ ЭДС ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА, СОСТАВЛЕННОГО ИЗ МАГНИЕВОГО И ЦИНКОВОГО ЭЛЕКТРОДОВ ПРИ 250C, ЕСЛИ КОНЦЕНТРАЦИИ ИОНОВ Mg2+ И Zn2+ В РАСТВОРЕ ОДИНАКОВЫ И РАВНЫ 0,1 МОЛЬ/Л.
Е0 (Мg2+/Mg) = – 2,37 B; Е0 (Zn2+/Zn) = – 0,74 B
1) -1,63B
2) +1,63B
3) –3,11B
4) + 3,11B
|
|
Дата добавления: 2014-11-20; Просмотров: 2574; Нарушение авторских прав?; Мы поможем в написании вашей работы!