
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окислительно-восстановительные потенциалы и электроды
|
|
|
|
Дополните высказывание
08. МАКСИМАЛЬНАЯ РАЗНОСТЬ ПОТЕНЦИАЛОВ, ВОЗНИКАЮЩАЯ НА ГРАНИЦЕ ТВЕРДАЯ ФАЗА – РАСТВОР В МОМЕНТ УСТАНОВЛЕНИЯ ЭЛЕКТРОХИМИЧЕСКОГО РАВНОВЕСИЯ НАЗЫВАЕТСЯ _______.
09. ВЕЛИЧИНУ ЭЛЕКТРОДНОГО ПОТЕНЦИАЛА РАССЧИТЫВАЮТ ПО УРАВНЕНИЮ ___________.
10. В ЭЛЕКТРОХИМИЧЕСКОМ РЯДУ НАПРЯЖЕНИЙ МЕТАЛЛЫ РАСПОЛОЖЕНЫ В ПОРЯДКЕ ________ ИХ АКТИВНОСТИ.
Контрольные задания
11. Рассчитать величину электродного потенциала цинкового электрода, если активная концентрация ионов цинка в жидкой фазе составляет 0,2 моль/дм3. Е0 (Zn2+/Zn) = – 0,76 В.
12. Вычислить активную концентрацию ионов меди Cu2+ в жидкой фазе медного электрода при Т = 298 К, если Е (Сu2+/Cu) = 0,8 В, Е0(Сu2+/Cu) = 0,35 В.
13. Как изменится потенциал хромового электрода, если активную концентрацию ионов Cr2+ в жидкой фазе электрода при 298 К понизить от 0,08 моль/дм3 до 0,05 моль/дм3?
Е0 (Cr2+/Cr) = – 0,913 В.
14. Для определения рН желчи была составлена водородно-хлорсеребряная цепь, ЭДС которой оказалась равной 0,577 В при 298 К. Определить потенциал водородного электрода и рассчитать рН исследуемой биологической жидкости.
(Ответ: рН = 12)
15. На миллиметровой бумаге построить калибровочный график зависимости ЭДС гальванической цепи от рН стандартных растворов по результатам потенциометрического анализа с использованием гальванической цепи включающей хлорсеребряный электрод сравнения и стеклянный электрод определения:
| рН | ЭДС, мВ |
| 1,0 | |
| 2,0 | |
| 3,0 | |
| 4,0 | |
| 5,0 |
По калибровочному графику определить рН исследуемого раствора, если ЭДС составила 150 мВ. Рассчитать концентрацию ионов Н+ в исследуемом растворе.
16. Провели потенциометрическое титрование 50 мл анализируемого раствора хлорида калия стандартным раствором нитрата серебра с молярной концентрацией С(AgNO3) = 0,10 моль/л. Получили следующие результаты: V(AgNO3) – объём прибавленного титранта, Е – ЭДС цепи соответственно:
| V(AgNO3), мл | 23,50 | 24,00 | 24,20 | 24,30 | 24,40 | 24,50 | 25,00 | 25,50 |
| Е, мВ |
Постройте кривые потенциометрического титрования и определите молярную концентрацию С(KCl) исследуемого раствора хлорида калия.
Литература
- Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для вузов / Ю. А. Ершов, В.А. Попков, А.С. Берлянд и др.; Под ред. Ю.А. Ершова. – 5-е изд., стер. – М.: Высш.шк., 2005. – С. 450 – 451.
- Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: Учеб. пособие для студентов медицинских спец. вузов / Ю.А. Ершов, А.М. Кононов, С.А. Пузаков и др.; Под ред. Ю.А. Ершова, В.А. Попкова. – М.: Высш. шк., 2008. – С. 179-184.
Раствор, содержащий одновременно окисленную и восстановленную формы вещества, называют окислительно-восстановительной системой (о/в) системой.
Инертный токопроводящий металл (например, платина или иридий), погруженный в окислительно-восстановительную систему, образует окислительно-восстановительный электрод.
Например: раствор, содержащий соль Cu2+ и соль Cu+ – является окислительно-восстановительной системой.
Cu2+ - окисленная форма;
Cu+ -восстановленная форма.
Электродная реакция
Cu2++1e ↔ Cu+
Примером о/в электрода может служить платиновая пластинка, опущенная в о/в - систему, содержащую окисленную и восстановленную форму вещества.
Рt | Cu2+; Cu+
Стандартный электродный о/в потенциал Е0Сu2+/Cu+ = +0,153 В
Потенциал, возникающий на границе соприкосновения пластинки инертного металла с о/в - системой, называется о/в или red–ox -потенциалом.
На практике определение стандартных о/в потенциалов различных систем проводят по отношению к нормальному водородному электроду при t = 25 °С и рН=0. По этим потенциалам составляют электрохимический ряд активности,который позволяет судить о возможности и направлении о/в процессов.
Чем больше величина стандартного о/в потенциала, тем сильнее окислительные свойства системы.
Чем меньше величина Е0о/в, тем сильнее восстановительные и слабее окислительные свойства вещества.
Величину о/в потенциала рассчитывают по уравнению Нернста-Петерса
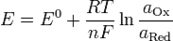
При Т = 298 К уравнение Нернста-Петерса имеет вид

Например, электродный о/в потенциал системы Cu2++1e ↔ Cu+ по уравнению Нернста- Петерса при Т = 298 К равен:

 | |||
 |
Е (Сu2+/Cu) = Е0 (Сu2+/Cu) + lg
По величине стандартных о/в потенциалов можно определять направление самопроизвольного протекания реакций, а также вычислять ЭДС элементов построенных на основе этих реакций.
Чем выше значение стандартного электродного потенциала Е0, тем выше окислительная способность системы, т.е. на этом электроде будет протекать процесс восстановления. На электроде с более отрицательным значением Е0, где выше восстановительная способность системы, протекает процесс окисления.
Например, определим направление реакции:
2Fe3+ + 2I– ↔ 2Fe2+ + I2
Е0 (Fe3+/Fe2+) = 0,77 В – окислитель
Е0 (I2/2I–) = 0,54 В – восстановитель
Потенциал первой системы больше, т.е. способность притягивать электроны у Fe3+ выше, чем у I2. Следовательно, реакция протекает в прямом направлении. Определим ЭДС элемента, построенного на основе этой реакции:
Pt│Fe3+; Fe2+║I-; I2│Pt
ЭДС = 0,77 – 0,54 = 0,23 В.
Электроны перемещаются от более активного о/в электрода ( менее положительного)к менее активному о/в электроду (более положительному). Окислительно-восстановительный процесс может протекать в нужном направлении при условии, что ЭДС будет положительна.
Контрольные вопросы
1. Окислительно – восстановительные системы, их классификация.
2. Окислительно-восстановительные электроды. Роль инертного металла в них. Применение в медицине.
3. Окислительно-восстановительные потенциалы.
4. Уравнение Нернста – Петерса для простых и сложных окислительно-восстановительных систем, его анализ.
5. Направление окислительно-восстановительных процессов.
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 3127; Нарушение авторских прав?; Мы поможем в написании вашей работы!