
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определение молярной массы сложного вещества
|
|
|
|
ЛАБОРАТОРНАЯ РАБОТА №2.
Вопросы к защите лабораторной работы №1.
1. Что называют эквивалентом вещества?
2. В чем заключается отличие эквивалента от формульной единицы вещества?
3. Что показывает эквивалентное число? Какие значения оно может принимать?
4. Почему эквивалентное число для одного и того же вещества может иметь разные значения? От чего это зависит?
5. Как рассчитывается эквивалентное число вещества в окислительно-восстановительных реакциях?
6. Что называют молярной массой эквивалентов вещества? Как она может быть рассчитана? Единицы измерения?
7. Как рассчитать Мэк(В) оксидов, кислот, оснований, солей по правилу сложения (аддитивности)?
8. Что называют молярным объемом эквивалентов газообразного вещества? Как он может быть рассчитан? Единицы измерения.
9. Как формулируется закон эквивалентов? Приведите его математическое выражение.
10. Сущность метода определения Мэк(Al) в данной работе.
11. Как проверяют прибор для определения объема выделившегося в реакции газа на герметичность?
12. Как производят замер объема выделившегося водорода?
13. С какой целью совмещают уровни воды в бюретке и уравнительной воронке?
14. Как приводят объем водорода к нормальным условиям (н.у.)? Зачем это делают?
15. Как рассчитывают парциальное давление водорода в данной работе?
16.Какой объем кислорода при н.у. требуется для сжигания 16 моль эквивалентов магния?
17.Вычислите Мэк всех веществ и Vэк газов в реакциях:
a) KHS + KOH = K2S + H2O
б) C(т) + 2N2O(г) = CO2(г) + 2N2(г)
в) 2KClO3 (т) = 2KCl (т) + 3O2 (г)
г) I2 (г) + 5CO2(г) = I2O5(т) + 5CO(г)
Цель работы: определение молярной массы эквивалентов неизвестной кислоты методом титрования.
Приборы и реактивы: раствор NaOH, 0,1 н раствор HCl, бюретки, фенолфталеин, раствор неизвестной кислоты, конические колбы.
Молярную массу неизвестной кислоты определяют титрованием раствора данной кислоты раствором щелочи (NaOH), концентрация которого должна быть известна. Раствор, концентрация которого точно установлена, называется титрованным.
Сущность метода титрования состоит в точном определении объема титрованного раствора, который надо прибавить к определенному объему анализируемого вещества, чтобы протекающая между ними химическая реакция прошла в строго эквивалентных количествах, т.е. чтобы после реакции не осталось избытка ни одного из реагирующих веществ. Заметить конец реакции позволяет индикатор, изменяющий свою окраску в момент окончания реакции, т.е. в момент достижения точки эквивалентности. Расчеты по результатами титрования проводят с использованием закона эквивалентов.
Для реагирующих между собой веществ А и В, находящихся в растворах, закон эквивалентов запишется следующим образом (см. теор. часть, уравн. 27):
nэк(А) = nэк(В)
где nэк(А), nэк(В) – количество вещества эквивалентов реагентов.
Количество вещества эквивалентов nэк можно рассчитывать по разному в зависимости от данных величин (см. теор. часть, уравнения (21) и (33)).
Если известна молярная концентрация эквивалентов и объем раствора, то:
nэк(А) = Cэк(А) · V(А), (45)
nэк(В) = Cэк(В) · V(В). (46)
Если известна масса растворенного вещества m(B) и его молярная масса эквивалентов Mэк(В), то:
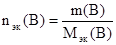 (47)
(47)
Следовательно, форма записи закона эквивалентов для реагирующих между собой веществ, находящихся в растворах, так же может быть различна:
Cэк(А) · V(А) = Cэк(В) · V(В) (48)
или
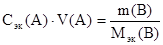 (49)
(49)
Зная три величины из четырех в уравнениях (48) и (49), можно рассчитать четвертую, в частности Mэк(В).
Данная лабораторная работа включает два опыта.
В первом опыте уcтанавливают точную концентрацию раствора щелочи (NaOH).
Во втором опыте, используя титрованный раствор NaOH, определяют молярную массу эквивалентов неизвестной кислоты.
Опыт 1. Установление точной концентрации раствора NaOH.
1.В две чистые конические колбы из бюретки налейте по 10 см3 раствора HCl, молярная концентрация эквивалентов которого известна.
2.В колбы с растворами HCl добавьте по 2 – 3 капли фенолфталеина, который в кислой среде останется бесцветным.
3.Заполните бюретку, установленную на рабочем месте, раствором NaOH, концентрацию которого необходимо определить. Уровень раствора NaOH в бюретке должен быть выше нулевого деления.
4.Удалите воздух из носика бюретки и установите уровень раствора NaOH в бюретке на нулевое деление.
5.Оттитруйте раствор кислоты в первой колбе. Для этого в колбу с отмеренным объемом кислоты приливайте из бюретки раствор NaOH, регулируя одной рукой подачу раствора из бюретки, а другой перемешивая раствор кислоты. Капля за каплей щелочь постепенно нейтрализует кислоту в соответствии с реакцией:
NaOH + HCl = NaCl + H2O. (50)
При достижении точки эквивалентности, в которой
nэк(NaOH) = nэк(HCl), (51)
добавление одной капли раствора щелочи вызовет появ- ление розовой окраски фенолфталеина. Титрование считается законченным, когда розовая окраска при перемешивании раствора не исчезает в течение ≈ 1мин.
Избыточное количество щелочи недопустимо!
6. По показанию бюретки (нижняя точка мениска раствора) определите объем щелочи V1(NaOH), пошедший на титрование.
7. Установите уровень раствора NaOH в бюретке на нулевую отметку, доливая раствор щелочи в бюретку через воронку.
8. Оттитруйте раствор HCl во второй колбе. Определите объем щелочи V2(NaOH)(см. п. 5 и п. 6).
9. Из полученных двух результатов V1(NaOH) и V2(NaOH) вычислите среднее значение V(NaOH).
10. Рассчитайте Сэк(NaOH), используя закон эквивалентов (уравнение (48)).
Результаты опыта 1 записать в следующей форме:
1. Объем раствора HCl V1(HCl) = …см3
V2(HCl) = …см3
2. Концентрация раствора HCl Сэк(HCl) = …моль-эк/л
3.Объем раствора NaOH, пошедший на титрование
V1(NaOH) = …см3
V2(NaOH) = …см3
4. Средний объем раствора NaOH, пошедший на титрование
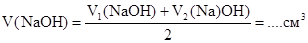
Расчет Сэк(NaOH)
1.Согласно закону эквивалентов для реакции (50)
nэк(NaOH) = nэк(HCl) (52)
2.Выразим nэк(NaOH) и nэк(HCl) через молярные концентрации эквивалентов этих растворов и их объемы (уравнение (48)):
Cэк(HCl) · V(HCl) = Cэк(NaOH) · V(NaOH) (53)
3.Из уравнения (53) выразить неизвестную величину Cэк(NaOH), используя значения соответствующих величин и произвести расчет, подставляя средний объем раствора NaOH.
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 989; Нарушение авторских прав?; Мы поможем в написании вашей работы!