
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Дифенилы и бинафтилы (атропоизомерия)
|
|
|
|
Аллены
Хиральные соединения без асимметрических (стереогенных) атомов
Лекция 14
Аллены – класс соединений, проявляющий аксиальную хиральность. В аллене, замещённом по концевым атомам, нет стереогенных центров, и, тем не менее, он может существовать в виде пары энантиомеров. Конечно, для возникновения такой асимметрии аллен должен иметь чётное количество кумулированных кратных связей.

Если сам процесс возникновения хиральности в алленах понятен, то с номенклатурой энантиомеров всё не так просто. Для обозначения двух зеркальных отражений структуру рассматривают как вытянутый тетраэдр и смотрят вдоль его оси.
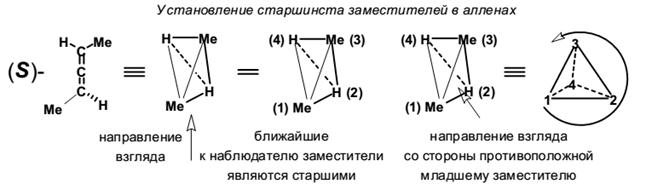
Далее рассматривают этот тетраэдр со стороны одной из граней (грань выбирается произвольно, стереохимический результат будет одинаков во всех случаях). При этом два заместителя оказываются приближенными к наблюдателю, а два других удалены. В соответствии с правилами КИП приписывают старшинство заместителей, отдавая предпочтение заместителям расположенным ближе по отношению к наблюдателю (т.е. ближайшие заместители получают номера 1 и 2, а дальние − всегда 3 и 4). После того как старшинство будет присвоено заместителям, располагают тетраэдр таким образом, что бы младший заместитель смотрел от наблюдателя (оказался наиболее удалён). Если старшинство ближайших, старших трёх заместителей падает по часовой стрелке, то это R-энантиомер. В противоположном случае – наоборот S антипод.
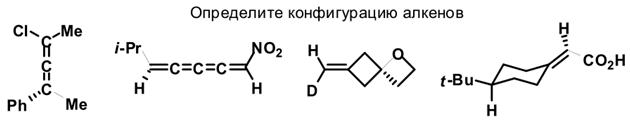
Не следует думать, что изложенный подход к номенклатуре энантиомеров применим лишь к хиральным алленам. Аналогично можно называть любые молекулы с аксиальной хиарльностью. Попробуйте самостоятельно назвать следующие объекты.
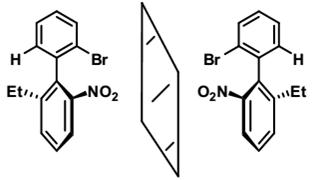
К соединениям проявляющим аксиальную хиральность, относятся также орто-замещённые бифенилы и бинафтилы. Хиральность этих соединений обусловлена затруднённым вращением вокруг связи, соединяющей ароматические кольца.
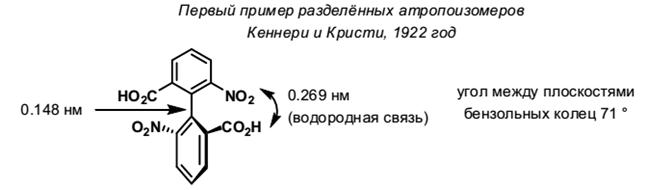
Впервые расщепление 2,2’-динитро-6,6’-дифеновой кислоты было проведено Кеннери и Кристи в 1922 году.
Заместители в орто-положениях затрудняют свободное вращение фенильных колец и препятствуют их расположению в одной плоскости. В результате кольца располагаются ортогонально (практически перпендикулярно) друг к другу. Если заместители с обеих сторон связи, соединяющей кольца, различны, то структура способна существовать в виде двух энантиомеров. Такие стереоизомеры, образующиеся в результате затруднённого вращения вокруг простой связи, называют аторопоизомерами (а – не, tropos – поворот, греч.).
Очевидно, что для возникновения атропоизомерии необходимо чтобы заместители в орто- и орто’-положениях находились достаточно крупные заместители. Если эффективный объём заместителей окажется ниже определённого предела произойдёт проворачивание фенильного кольца, что ведёт к рацемизации.

Поэтому оптическая стабильность атропоизомеров может служить мерой величины заместителей и наоборот. В общем случае, возможно расщепить орто-, орто’-дифенилы если суммарный объём двух заместителей в соседних ядрах превышает 2.9 Å (в этом случае энергетический барьер вращения составляет более 25 ккал/моль). Для примера, барьер вращения в дифеновой кислоте составляет ~ 15 ккал/моль, в орто-,орто’-дииоддифениле – 21 ккал/моль, а бутене-2 ~ 40 ккал/моль. Из сказанного следует, что для разделения моно-R-орто-замещённого дифенила на энантиомеры, необходимо чтобы R имел эффективный объём больший, чем у атома брома.

Номенклатура оптических изомеров дифенилов строится аналогично алленам. Приведём пример определения стереохимического дескриптора 2,2’-бинафтола, на основе которого готовятся многие хиральные реагенты, например, BINAL-H.
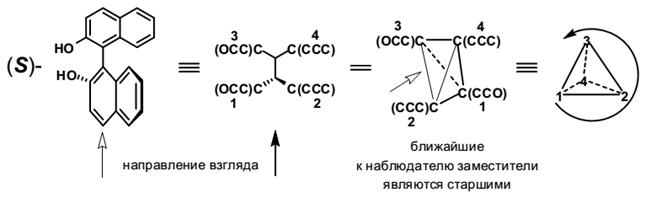
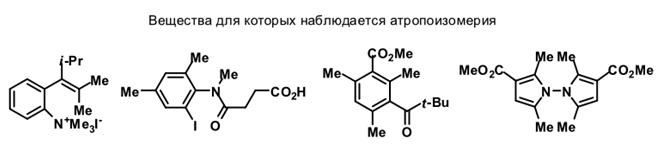
Аналогичная атропоизомерия встречается не только в бифенилах.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 4937; Нарушение авторских прав?; Мы поможем в написании вашей работы!