
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения задач. Пример 1 Баллон вместимостью V = 5 л содержит смесь гелия и водорода при давлении P = 600 кПа
|
|
|
|
Пример 1 Баллон вместимостью V = 5 л содержит смесь гелия и водорода при давлении P = 600 кПа. Масса m смеси равна 4 г, массовая w1 доля гелия равна 0,6. Определить температуру смеси, парциальные давления P1 и P2 , молярную массу смеси.
Решение.
Массовая доля w – отношение массы компонента смеси к массе смеси, т.е.  . Аналогично,
. Аналогично, 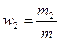 . Следовательно,
. Следовательно, 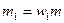 и
и 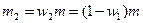 .
.
Найдем молярную массу смеси:
 .
.
Здесь М1 и М2 – молярные массы компонентов смеси; М1 = 4×10 -3 кг/моль, М2 = 2×10 -3 кг/моль. Получаем:
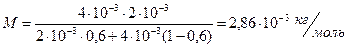 .
.
Запишем уравнение Клапейрона – Менделеева для смеси:
 .
.
Отсюда выразим и найдем температуру смеси:
 .
.
Парциальное давление – давление, создаваемое компонентом смеси в сосуде. Таким образом, для нахождения можно использовать уравнение Клапейрона – Менделеева:
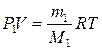 .
.
Отсюда выразим и найдем парциальное давление Р1:
 .
.
Используя закон Дальтона Р = P1 + P2, находим P2:
Р2 = P - P1 = 600 - 257,3 = 342,7 кПа.
Ответ: 258 К; 257,3 кПа; 342,7 кПа; 2,86×10-3 кг/моль.
Пример 2 Определить кинетическую энергию  вращательного движения одной молекулы кислорода при температуре Т = 286 К, а также кинетическую энергию
вращательного движения одной молекулы кислорода при температуре Т = 286 К, а также кинетическую энергию 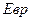 вращательного движения всех молекул этого газа, если его масса равна 4 г.
вращательного движения всех молекул этого газа, если его масса равна 4 г.
Решение.
На каждую степень свободы молекул газа приходится одинаковая средняя энергия 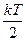 , где k = 1,38×10-23 Дж/К – постоянная Больцмана. Так как молекула кислорода двухатомная, то имеет 3 степени поступательного движения и 2 степени вращательного движения. Таким образом,
, где k = 1,38×10-23 Дж/К – постоянная Больцмана. Так как молекула кислорода двухатомная, то имеет 3 степени поступательного движения и 2 степени вращательного движения. Таким образом,
 .
.
Кинетическая энергия вращательного движения всех молекул этого газа:
 ,
,
где N – число молекул газа, определяемое по формуле 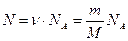 .
.
Таким образом, получаем
 .
.
Ответ: 297Дж.
Пример 3 В центрифуге находится азот при температуре 170С. Центрифуга, внутренний радиус которой 0,5 м, вращается вместе с азотом с частотой 80 с-1. Во сколько раз давление в центре центрифуги меньше давления на расстоянии 0,4 м от оси вращения?
Решение.
Используем для решения распределение Больцмана в виде
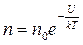 ,
,
где U – потенциальная энергия поля. Учтем, что вместо концентрации можем записать давление, так как 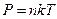 и
и 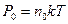 . В этом случае получим
. В этом случае получим
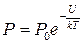 .
.
На частицы газа в центрифуге действует центробежная сила инерции
 .
.
Используем связь между потенциальной энергией и силой:
 .
.
Тогда получим вид потенциального поля в центрифуге
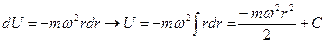 .
.
Примем постоянную интегрирования С = 0. Тогда получим выражение для расчета давления газа в центрифуге:
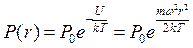 .
.
Отсюда находим искомое отношение: 
Учтем, что 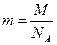 - масса молекулы кислорода,
- масса молекулы кислорода, 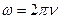 - угловая скорость вращения,
- угловая скорость вращения, 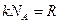 - универсальная газовая постоянная.
- универсальная газовая постоянная.
В итоге получаем
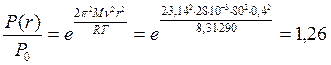
Ответ: в 1,26 раз.
Пример 4 Рассчитать среднее число столкновений, испытываемых за 5 с молекулой азота при температуре 170С и давлении 105 Па.
Решение.
Среднее число столкновений, испытываемых одной молекулой за единицу времени, равно
 ,
,
где d – эффективный диаметр молекулы; n - концентрация молекул; 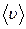 - средняя арифметическая скорость теплового движения молекул.
- средняя арифметическая скорость теплового движения молекул.
За время t число столкновений составит
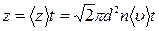 (1)
(1)
Средняя арифметическая скорость определяется выражением
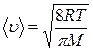 .
.
Найдем концентрацию молекул:
 .
.
Из уравнения Клапейрона - Менделеева выразим
 .
.
Подставив полученные выражения в (1), получим:
 .
.
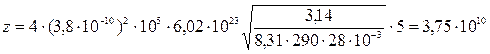 .
.
Ответ: 3,75×1010.
Пример 5 Найти показатель адиабаты g для смеси газов, состоящей из количества n1 = 5 моль гелия и количества n2 = 3 моль азота.
Решение.
Показателем адиабаты g называется отношение удельных теплоемкостей смеси газа cv (при постоянном объеме) и ср (при постоянном давлении)
 .
.
Удельную теплоемкость смеси газа cv при постоянном объеме найдем из уравнения теплового баланса: количество теплоты, затраченное на нагрев смеси, равно количеству теплоты, идущему на нагрев компонент смеси, т.е.
 .
.
Учтем, что 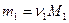 ,
,  ,
,  ,
, 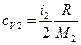 , а Dt одинаково, тогда получим
, а Dt одинаково, тогда получим

Отсюда выражаем cv:
 .
.
Гелий – одноатомный газ, поэтому у него число степеней свободы i1 = 3, молярная масса гелия М1 = 4×10-3 кг/моль. Азот – двухатомный газ, поэтому у него число степеней свободы i2 = 5, молярная масса азота М2 = 28×10-3 кг/моль.
Проводя аналогичные выкладки для расчета удельной теплоемкости смеси газа ср при постоянном давлении, с учетом того, что 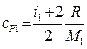 и
и  , получаем:
, получаем:
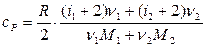 .
.
Тогда показателем адиабаты g будет определяться выражением
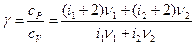 .
.
Подставляя числовые значения, получим
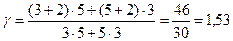 .
.
Ответ: 1,53.
Пример 6 Кислород занимает объем V1 = 1л и находится под давлением Р1 = =200 кПа. Газ нагрели сначала при постоянном давлении до объема V2 = 3л, а затем при постоянном объеме до давления Р3 = 500 кПа. Найти: изменение DU внутренней энергии газа; совершенную им работу А; количество теплоты Q, переданное газу.
Решение.
Изменение внутренней энергии газа при его переходе из состояния 1 в состояние 3 найдем по формуле
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 5443; Нарушение авторских прав?; Мы поможем в написании вашей работы!