
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изменение энтропии в необратимых термодинамических процессах изолированных систем
|
|
|
|
Объединенные уравнения 1-го и II-го законов термодинамики
Как известно, аналитически II закон ТТД выражается в следующем виде:
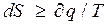 или
или 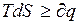 , (6.9)
, (6.9)
Известно, что в соответствии с уравнением 1-го закона ТТД
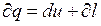 , (6.10)
, (6.10)
Подставим значения 6q из этих выражений соответственно в уравнение (6.9), получим
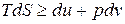 , (6.11)
, (6.11)
Это соотношение называется объединенным уравнением 1-го и П-го законов ТТД. В дальнейшем мы будем применять эти уравнения главным образом для систем, находящихся в равновесном состоянии. Для таких систем объединенное уравнение 1-го и П-го законов ТТД можно записать следующим образом
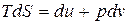 , (6.12)
, (6.12)
Рассмотрим принципиальное отличие необратимых процессов от обратимых на примере расширения газа в цилиндре под поршнем (рис 6.2), получающего теплоту 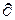 q от источника с температурой T1 и совершающего работу против внешней силы Р, удерживающей поршень.
q от источника с температурой T1 и совершающего работу против внешней силы Р, удерживающей поршень.
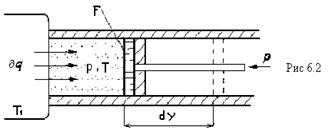 Расширение будет обратимым(равновесным) только в том случае,если -температура газа Т равна температуре источника Т1
Расширение будет обратимым(равновесным) только в том случае,если -температура газа Т равна температуре источника Т1
(Т = T1), внешняя сила Р равна давлению газа на поршень Р = pF и при расширении газа нет ни внешнего, ни внутреннего трения. Работа расширения газа в этом случае равна 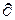 l обр = P . dv, a изменение энтропии рабочего тела в таком процессе dSo6p =
l обр = P . dv, a изменение энтропии рабочего тела в таком процессе dSo6p = 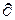 q / Т.
q / Т.
Невыполнение хотя бы одного из указанных условий делает расширение газа необратимым. Если необратимость вызвана трением поршня о стенки цилиндра, то работа 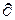 l, совершаемая против внешней силы Р, оказывается меньше, чем p.dv, т.к. часть ее затрачивается на преодоление трения и переходит в теплоту
l, совершаемая против внешней силы Р, оказывается меньше, чем p.dv, т.к. часть ее затрачивается на преодоление трения и переходит в теплоту 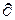 qmp. Она воспринимается газом вместе с подведенной теплотой,
qmp. Она воспринимается газом вместе с подведенной теплотой, 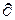 q, в результате чего возрастание энтропии газа в необратимом процессе dS =(
q, в результате чего возрастание энтропии газа в необратимом процессе dS =(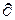 q +
q + 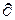 qmp)/ Т оказывается больше, чем в обратимом при том же количестве подведенной от источника теплоты
qmp)/ Т оказывается больше, чем в обратимом при том же количестве подведенной от источника теплоты 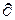 q. Следовательно, изменение энтропии всей рассматриваемой системы в результате осуществления цикла равно:
q. Следовательно, изменение энтропии всей рассматриваемой системы в результате осуществления цикла равно:
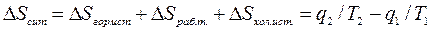 , (6.13)
, (6.13)
Это состояние справедливо для любых обратимых и необратимых циклов, осуществляемых между двумя источниками теплоты.
Возрастание энтропии cистемы при необратимых процессах связано с тем, что энтропия рабочего тела за цикл не изменяется, а уменьшение энтропии горячих источников меньше по абсолютной величине, чем увеличение энтропии холодных источников теплоты.
Таким образом, в результате осуществления необратимого цикла энтропия изолированной системы возрастает dScucm > 0.
Таким образом, какие бы процессы не протекали в изолированной системе, ее энтропия не может уменьшаться: 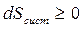 , (6.14)
, (6.14)
здесь знак равенства соответствует обратимым процессам, а знак неравенства - необратимым.
Отсюда следует важный вывод: изолированная система, достигшая равновесного состояния, в дальнейшем в этом состоянии и пребывает, т.е. является неспособной к самопроизвольному изменению состояния. В самом деле, любой самопроизвольный процесс необратим и, следовательно, протекает с ростом энтропии. Однако энтропия изолированной системы имеет максимум в состоянии равновесия, следовательно, в равновесной изолированной системе невозможны самопроизвольные процессы.
Такм образом, самопроизвольные процессы продолжаются в изолированной системе до тех пор, пока энтропия системы не достигнет максимума. По достижении состояния равновесия, которому соответствует максимально возможное для данной системы значение энтропии, самопроизвольные процессы в системе прекращаются и система пребывает в состоянии равновесия.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 622; Нарушение авторских прав?; Мы поможем в написании вашей работы!