
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Приведенное уравнение Ван-дер-Ваальса. Закон соответственных состояний. Критические параметры вещества
|
|
|
|
Особенно интересно уравнение Ван-дер-Ваальса (9.1) тем, что оно качественно отображает главную особенность реальных газов – способность переходить при определенных условиях в жидкое состояние. Наглядное представление об этом получается, если преобразовать его в уравнение 3-ей степени относительно V. Для этого в ур-ии (9.1) раскроем в левой части скобки: 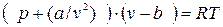 ,
,
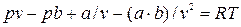
Умножив обе стороны равенства на v 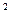 и разделив на р, получаем после приведения подобных членов:
и разделив на р, получаем после приведения подобных членов: 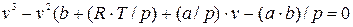 , (9.5)
, (9.5)
Полученное уравнение имеет три корня, т.е. при заданных параметрах p и Т здесь возможны три случая: один корень действительный и два мнимых; все три корня действительные и различные; все три корня действительные и равные.
Рассмотрим в системе координат p- v изотермы, построенные по приведенному уравнению Ван-дер-Ваальса, для разных температур. (рис. 9.2).
Из рисунка видно, что вид изотерм меняется в зависимости от температуры.
Первый случай имеет место при высоких температурах, когда изотермы имеют вид гиперболического характера (например, линия 1-2). В этом случае каждому давлению соответствует вполне определенный удельный объем (например, давлению р 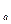 соответствует удельный объем v
соответствует удельный объем v  ). Это значение удельного объема и является действительным корнем уравнения (9.1), оба же мнимых корня в этом случае физического смысла не имеют и должны быть отброшены. Тело в этом случае при любых давлениях находится в газообразном состоянии. Это так наз. сверхкритические изотермы вандерваальского газа, т.е. изотермы при Т>T
). Это значение удельного объема и является действительным корнем уравнения (9.1), оба же мнимых корня в этом случае физического смысла не имеют и должны быть отброшены. Тело в этом случае при любых давлениях находится в газообразном состоянии. Это так наз. сверхкритические изотермы вандерваальского газа, т.е. изотермы при Т>T 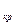 .
.
Второй случай имеет место при сравнительно низких температурах, когда изотермы имеют два перегиба (например, линия 3-4). Это так наз. докритическая область, у которой Т<T 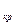 . На изотермах одному значению давления р соответствует три значения удельного объема (например, давлению р
. На изотермах одному значению давления р соответствует три значения удельного объема (например, давлению р 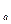 соответствуют удельные объемы v
соответствуют удельные объемы v 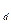 , v
, v 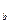 , v
, v 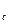 ), которые и являются тремя действительными и различными корнями уравнения (9.1). Участок 3-b соответствует изотермическому сжатию тела, находящегося в газообразном состоянии, причем в точке b оно уже начинает переходить в жидкое состояние. Точка d соответствует такому состоянию, когда оно уже полностью превратилось в жидкость, в соответствие с чем участок d-4 представляет собой изотермическое сжатие жидкости. Точка с соответствует промежуточному двухфазному состоянию тела. Участок кривой b-f соответствует неустойчивому состоянию переохлажденного пара, а участок d-e, также неустойчивому состоянию перегретой жидкости. Что же касается участка e-f, то он вообще физического смысла не имеет, поскольку в действительности при изотермическом сжатии тело переходит из газообразного в жидкое состояние при постоянном давлении, т.е. по горизонтальной линии b-d.
), которые и являются тремя действительными и различными корнями уравнения (9.1). Участок 3-b соответствует изотермическому сжатию тела, находящегося в газообразном состоянии, причем в точке b оно уже начинает переходить в жидкое состояние. Точка d соответствует такому состоянию, когда оно уже полностью превратилось в жидкость, в соответствие с чем участок d-4 представляет собой изотермическое сжатие жидкости. Точка с соответствует промежуточному двухфазному состоянию тела. Участок кривой b-f соответствует неустойчивому состоянию переохлажденного пара, а участок d-e, также неустойчивому состоянию перегретой жидкости. Что же касается участка e-f, то он вообще физического смысла не имеет, поскольку в действительности при изотермическом сжатии тело переходит из газообразного в жидкое состояние при постоянном давлении, т.е. по горизонтальной линии b-d.
Третий случай имеет место при вполне определенной для каждого тела температуре, когда т.b и d, сближаясь с повышением температуры, сливаются в одну т.К, в которой имеет место перегиб соответствующей изотермы, причем касательная к ней в этой точке имеет горизонтальное направление. Для изотермы Т=Т 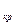 характерно наличие точки перегиба К, в которой удельные объемы v
характерно наличие точки перегиба К, в которой удельные объемы v 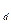 , v
, v 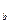 , v
, v 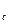 совпадают, т.е. три действительные корня равны.
совпадают, т.е. три действительные корня равны.
Участок d-e и f-b на изотермах можно воспроизвести экспериментально только для «чистых» жидкостей и паров, из которых предварительно удалены воздух и чистые примеси. Участок d-e соответствует метастабильному состоянию жидкости (перегретая жидкость). Жидкость, из которой удалены растворенные в ней газы, при спокойном нагревании без колебаний в сосуде можно перегревать. Состояние перегретой жидкости неустойчиво. Малейшее возмущение (встряхивание) вызывает вскипание и переход процесса на линию d-b. Участок f-b соответствует метастабильному состоянию пара (переохлажденный пар). Экспериментально его можно получить, если очистить пар от пылинок и других загрязнений, вокруг которых начинают образовываться капельки жидкости. Конденсация задерживается, и пар перенасыщается. Состояние пара на участке f-b также неустойчиво. Появление любых центров конденсации быстро вызывает расслоение пара на две фазы, в результате чего процесс переходит на линию d-b. Точки на участке e-c-f изотермы экспериментально обнаружить не удается.
Точка К наз. критической точкой, а соответствующие ей параметры р 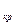 , v
, v 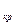 , Т
, Т 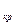 наз. критическими параметрами.
наз. критическими параметрами.
Критическая температура, существование которой было открыто в 1861г. Д.И. Менделеевым, характеризуется тем, что при температурах выше нее невозможно путем изотермического сжатия добиться перехода газа в жидкое состояние.
Аналитически условия критического состояния тела выражаются уравнениями:
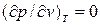
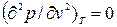 , (9.6)
, (9.6)
Первое из них показывает, что критическая изотерма в точке К имеет горизонтальную касательную, второе – что изотерма имеет в т.К перегиб.
Используя эти уравнения совместно с уравнениями состояния, можно определить значения критических параметров состояния газа.
Применительно к уравнению Ван-дер-Ваальса, критические параметры определяются следующим образом.
В уравнении (9.1) оставим переменную р в левой части, а переменную V перенесем в правую часть: 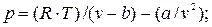
Дифференцируя это выражение по V, считая, что Т=const, и приравнивая полученное выражение к нулю: 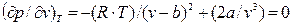 , (9.7)
, (9.7)
Определяем вторую производную и тоже приравниваем ее к нулю:
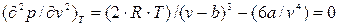 , (9.8)
, (9.8)
Для нахождения критических параметров следует решить совместно имеющиеся три уравнения (9.1), (9.7), (9.8). Представив два последних уравнения в виде:
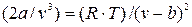 и
и 
Затем, разделив первое из них на второе, получим:
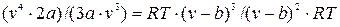 или 2 v =3 v -3b;
или 2 v =3 v -3b;
и, следовательно: 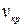 =3b, (9.9)
=3b, (9.9)
Подставив полученное значение в (9.7), получим:
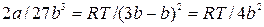
Откуда: 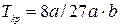 , (9.10)
, (9.10)
Далее, подставляя в уравнение (9.1) найденные значения v 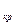 и Т
и Т 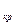 , получаем:
, получаем:
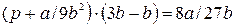
Откуда: 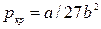 , (9.11)
, (9.11)
9.4. p, v, T – диаграмма при фазовых переходах жидкости и газа
Известно, что любое вещество в зависимости от давления и температуры может находиться в различных агрегатных состояниях (фазах): газообразном, жидком и твердом. Вещества в различных агрегатных состояниях имеют различные свойства, что объясняется характером межмолекулярного взаимодействия. Переход вещества из одного агрегатного состояния в другое, сосуществующее с первым, наз. фазовым переходом или фазовым превращением. Отличительной особенностью фазовых переходов является скачкообразное изменение плотности, удельной энтропии и других свойств веществ. Фазовые переходы могут проходить с поглощением или выделением теплоты. Переход вещества из одной фазы в другую, происходящий при Т=const и p=const до полного исчезновения этой фазы, наз. равновесным фазовым переходом. Равновесное состояние термодинамической системы, состоящей из двух или большего числафаз, наз фазовым равновесием. Фазовый переход из жидкого или газообразного состояния в кристаллическое наз. кристаллизацией, а обратный переход из кристаллического состояния в жидкое – плавлением, а непосредственно в газообразное (парообразное) наз. сублимацией, а обратный переход – десублимацией. Фазовый переход вещества из жидкого состояния в состояние пара наз. парообразованием, а обратный переход из парообразного состояния в жидкое (или кристаллическое) – конденсацией.
На рис. 9.4 приведена р, Т – диаграмма состояния воды с нанесенными на ней кривыми фазовых переходов.
 Из рисунка видно, что кривые АВ, АК, АД делят р,Т – диагр. на три области: 1 – область жидкого состояния (вода), 2 – область парообразного состояния (пар), 3 – область твердого состояния – лед. Кривая АВ характеризует равновесное состояние жидкой и твердой фаз. Она определяет зависимость температуры плавления от давления и разделяет области твердого и жидкого состояний. Эта кривая наз. кривой плавления. Кривая АК представляет собой кривую кипения (конденсации), которая характеризует состояние жидкой и паровой фаз, т.е. зависимость между давлением насыщенного пара и температурой кипения р=f (ts). Кривую кипения обычно называют кривой или линией насыщения. Линия АД, являющаяся кривой сублимации, характеризует равновесное состояние твердой и паровой фаз, т.е. зависимость между давлением насыщенного пара и температурой возгонки и сублимации р=f (ts). Точки на этой кривой соответствуют двухфазной системе лед-пар. Точка А пересечения двух кривых фазового равновесия представляет собой тройную точку, в которой одновременно сосуществуют три фазы: вода, пар и лед. Вид кривых АВ, АК и АД и их расположение на р,Т – диагр. зависит от природы веществ. Для воды кривая плавления АВ, вследствие ее аномальных свойств, имеет наклон влево, т.е. с повышением давления температура плавления льда уменьшается.
Из рисунка видно, что кривые АВ, АК, АД делят р,Т – диагр. на три области: 1 – область жидкого состояния (вода), 2 – область парообразного состояния (пар), 3 – область твердого состояния – лед. Кривая АВ характеризует равновесное состояние жидкой и твердой фаз. Она определяет зависимость температуры плавления от давления и разделяет области твердого и жидкого состояний. Эта кривая наз. кривой плавления. Кривая АК представляет собой кривую кипения (конденсации), которая характеризует состояние жидкой и паровой фаз, т.е. зависимость между давлением насыщенного пара и температурой кипения р=f (ts). Кривую кипения обычно называют кривой или линией насыщения. Линия АД, являющаяся кривой сублимации, характеризует равновесное состояние твердой и паровой фаз, т.е. зависимость между давлением насыщенного пара и температурой возгонки и сублимации р=f (ts). Точки на этой кривой соответствуют двухфазной системе лед-пар. Точка А пересечения двух кривых фазового равновесия представляет собой тройную точку, в которой одновременно сосуществуют три фазы: вода, пар и лед. Вид кривых АВ, АК и АД и их расположение на р,Т – диагр. зависит от природы веществ. Для воды кривая плавления АВ, вследствие ее аномальных свойств, имеет наклон влево, т.е. с повышением давления температура плавления льда уменьшается.
Кроме того, на рис. 9.4 показано как изменяется состояние вещества, если его нагреть при постоянном давлении р1 (р1> ра). Изобара р1-а-в-д характеризует процесс перехода твердого вещества в перегретый пар. На участке изобары р1-а происходит нагревание твердого вещества. В точке (а) на кривой плавления АВ оно превращается в жидкость. Температура, при которой осуществляется это фазовое превращение, наз. температурой плавления, а количество подводимой теплоты – скрытой теплотой плавления. Отрезок изобары а-в характеризует процесс нагревания жидкости. В точке (в), расположенной на кривой АК, жидкость превращается в пар. Дальнейшее продвижение по изобаре от точки (в) к точке (д) соответствует нагреванию пара. В точке (д) содержится перегретый пар.
Из р,Т – диагр. видно, что кривая насыщения АК в верхней части заканчивается критической точкой К. Выше критической точки переход их жидкого состояния в пар происходит непосредственно, минуя стадию двухфазного состояния.
Из этой же диагр. видно, что при Т>Ткр никаким изотермическим сжатием невозможно перевести пар в жидкость. Если нагревание твердого вещества проводить по изобаре р2-е-м (р2<ра), то при температуре Т2 (точка е на кривой АД) вещество переходит из твердого состояния в газообразное, минуя жидкость.
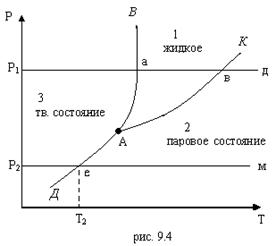
На рис. 9.5 приведены фазовые состояния вещества в р, v -, Т, v -, p, S - и T, S – диаграммах. На этих диаграммах область равновесия двух фаз изображается не одной линией, (как в р,Т – диаграмме), а представляет собой соответствующие площади диаграммы, разделенные линиями, которые наз. пограничными кривыми.
На приведенных диаграммах область 1 представляет собой твердую фазу, область 2 – равновесное состояние твердой и жидкой фаз, 3 – жидкую фазу, 4 – равновесное состояние жидкой и газообразной фаз, область 5 – газообразную фазу, 6 – равновесное состояние твердой и газообразной фаз, отрезок б-с-д – состояние, соответствующее тройной точке,
рис.9.5
т.е. в p, v -, T, v – и p,S -, T,S – диаграммах тройная точка оказывается развернутой в линию. Точка К явл. критической точкой вещества, линии с-К и К-д – левой и правой пограничными кривыми двухфазной области жидкость – пар. Линия с-К наз. пограничной кривой жидкости. В каждой точке этой кривой жидкость находится в равновесии со своим насыщенным паром, массовая доля жидкости равна единице. Насыщенный пар – это пар, находящийся в равновесном состоянии с жидкостью, из которой он образуется. Кривая К-д – пограничная кривая пара. В каждой точке этой кривой массовая доля пара равна единице. Отрезки б-м и с-н – кривые двухфазной области твердая фаза – жидкость (кривая плавления). Отрезки а-б и д-е – кривые двухфазной области твердая фаза – пар (кривая сублимации).
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 888; Нарушение авторских прав?; Мы поможем в написании вашей работы!