
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение состояния реального газа или уравнение Ван-дер-Ваальса
|
|
|
|
Уравнение состояния идеального газа было получено в предположении, что молекулы являются упругими шариками, движение которых подчиняется законам Ньютона, между ними отсутствуют силы взаимодействия, а объем, занимаемый молекулами, незначителен по сравнению с объемом газа. Однако в природе идеальных газов не существует.
Термодинамические процессы в реальных газах и парах
ЛЕКЦИЯ 9
Реальные газы, в отличие от идеальных, состоят из молекул конечного объема и связаны между собой силами взаимодействия. В зависимости от условия реальные газы могут переходить в жидкое или твердое состояние. Силы взаимодействия очень велики у твердых и жидких тел и достаточно велики у газов, близких к переходу из газообразного в жидкое состояние.
В течение длительного времени считалось, что все газы строго подчиняются уравнению Клапейрона. Но уже в конце XVII века, а затем в 20-тых годах ХIХ века экспериментальные исследования по проверке этого уравнения показали, что поведение реальных газов существенно отличается от идеального. Причем отличие свойств реального газа от идеального увеличивается с понижением температуры и повышением давления.
Одной из первых попыток в этой области была разработка голландского физика Н. Ван-дер-Ваальса в 1873 г. Это уравнение он получил на основе кинетической теории газов; учитывая объем самих молекул и силы взаимодействия между ними, уравнение имеет следующий вид: 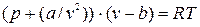 , (9.1)
, (9.1)
где а и b - константы, которые наряду с газовой постоянной характеризуют индивидуальные свойства вещества. Для данного газа они постоянны.
Одна поправка учитывает объем, недоступный для движения молекул в силу конечности объема самих молекул и наличия взаимодействия между ними. При беспредельном сжатии газа его объем будет стремиться не к нулю, как у идеальных газов, а к некоторому предельно малому объему b. Величина b больше суммарного объема молекул, так как в связи с наличием сил отталкивания, возникающих при их сближении, молекулы газа при сжатии его не могут быть доведены до соприкосновения. Величина b явл. суммарным объемом сферических оболочек, в пределы которых не могут проникнуть другие молекулы, и составляет примерно учетверенный объем самих молекул. В связи с этим в уравнение состояния следует вводить не полный объем газа v, а лишь свободный объем (v -b).
Другая поправка учитывает силы взаимного притяжения, действующие в направлении действия внешнего давления и как бы увеличивающая его на некоторую добавочную величину, наз. внутренним давлением. Полагая, что внутреннее давление газа изменяется пропорционально квадрату плотности или обратно пропорционально квадрату удельного объема газа, Ван-дер-Ваальс принял его равным 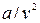 . Это отношение для жидких тел имеет большое значение (например для воды оно при 20
. Это отношение для жидких тел имеет большое значение (например для воды оно при 20  С составляет 1050 Мпа); для газов из-за малых сил сцепления оно очень мало. Поэтому внешнее давление, под которым находится жидкость, оказывает ничтожное влияние на ее объем, и жидкость считают практически несжимаемой. В газах, ввиду малости
С составляет 1050 Мпа); для газов из-за малых сил сцепления оно очень мало. Поэтому внешнее давление, под которым находится жидкость, оказывает ничтожное влияние на ее объем, и жидкость считают практически несжимаемой. В газах, ввиду малости 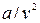 внешнее давление легко изменяет их объем.
внешнее давление легко изменяет их объем.
Таким образом, уравнение Ван-дер-Ваальса учитывает реальные свойства газа – наличие межмолекулярных взаимодействий в газах и собственный объем молекул.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 912; Нарушение авторских прав?; Мы поможем в написании вашей работы!