
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тепловая теорема Нернста
|
|
|
|
Прямой и простой расчет изменения энергии Гиббса, а, следовательно, и констант равновесия химических реакций не вызывает затруднений, если известны теплота химической реакции и абсолютные значения энтропии всех участников реакции. Постулат Планка дает такую возможность, т. е. возможность вычисления абсолютных значений энтропии индивидуальных веществ при любой температуре.
Тепловая теорема Нернста исторически предшествовала названному постулату и относится к тому периоду в развитии термодинамики, когда решение задачи об определении изменения энергии Гиббса реакции было связано с определенными трудностями.
Для расчета D G реакции — главной цели учения о химическом равновесии — требовались опытные определения:
– теплового эффекта реакции при какой-нибудь одной температуре
– теплоёмкостей в широком интервале температур
– констант равновесия при разных температурах для того, чтобы определить значение константы интегрирования I в уравнении Гиббса-Гельмгольца.
Получаемое в конечном результате уравнение D G = ¦(T) могло быть применимо в тех пределах температур, в которых определены теплоемкости и константы равновесия. Описанный нами путь являлся безукоризненным с опытной точки зрения; точность конечных расчетов полностью зависела от точности опытных данных. Очевидно, что весь этот путь являлся сугубо эмпирическим и притом очень трудоемким.
Нернст отчетливо поставил цель облегчить его теоретическими моментами. Рассуждения сводилась к следующему. Для вычисления D G химической реакции надо:
– опытным путем определить тепловой эффект реакции при какой-нибудь одной температуре
– опытным путем определить теплоёмкости в широком интервале температур
– создать теорию теплоёмкости для того, чтобы избежать эмпирических формул зависимости теплоёмкостей от температуры
– вывести уравнение для вычисления D G химической реакции непосредственно из уравнения Гиббса-Гельмгольца, совершенно не прибегая к опытным определениям констант равновесия.
Создать теорию теплоёмкости, которая бы количественно отображала действительные соотношения, не удалось.
Тем не менее, мысль Нернста вывести уравнение для D G химической реакции непосредственно из уравнения Гиббса-Гельмгольца
 (V, 15)
(V, 15)
представляла особый интерес.
Очевидно, что для вычисления D G по этой формуле надо знать кроме зависимости D H от Т, по меньшей мере значение D G при какой-либо одной температуре, чтобы определить константу интегрирования I. Наличие этой неопределенности в качестве решения уравнения (V, 15) дает семейство кривых (смотри рис.21, на котором это семейство кривых обозначено пунктирными линиями).
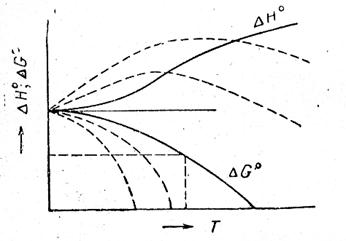
Рис. 21. Зависимость теплового эффекта и изменения энергии Гиббса химической реакции от температуры.
Причем, только одна из кривых является истинной (на рис. 21 она обозначена сплошной линией), т. к. энергия Гиббса — однозначная функция параметров состояния системы.
Руководствуясь рядом опытных указаний, Нернст высказал следующую гипотезу, получившую название тепловой теоремы Нернста: вблизи абсолютного нуля для конденсированных систем не только
D G 0 = D H 0, но и
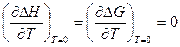 (V, 16)
(V, 16)
Графически это означает, что кривые D G и D H при абсолютном нуле соприкасаются, т. е. имеют общую касательную, причем эта касательная параллельна оси абсцисс (температур). Следовательно, из всего семейства кривых D G = ¦(T) реальной является та кривая, касательная которой при Т = 0 горизонтальна.
Если мы, как и раньше, представим D H в виде
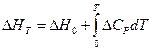
где D CP — разность теплоёмкостей продуктов реакции и исходных веществ, находящихся в конденсированном состоянии, то после подстановки в уравнение (V, 14) получим:
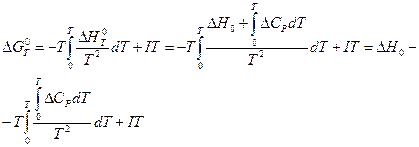 (V, 17)
(V, 17)
Берем теперь производную D G по Т, причем средний член справа в (V, 17) дифференцируем как произведение:
 (V, 18)
(V, 18)
(при дифференцировании  обращается в нуль, т. к. является константой и не зависит от температуры).
обращается в нуль, т. к. является константой и не зависит от температуры).
При переходе к пределу T ® 0 учитывается тот факт, что CP, а значит и D CP пропорциональны T 3 по закону Т -кубов Дебая (смотри (I, 22)). Тогда при приближении к T = 0 оба первых члена в правой стороне уравнения (V, 18) обращаются в нуль. С учетом (V, 16) получаем:
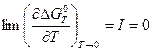
Следовательно, при температурах, близких к абсолютному нулю, константа интегрирования I в уравнении Гиббса-Гельмгольца также обращается в нуль.
Таким образом, для реакций в конденсированных системах в области абсолютного нуля уравнение (V, 17) переходит в уравнение:

Опираясь на тепловую теорему Нернста, был сделан ряд важных и интересных заключений относительно энтропии твердых тел.
Т. к. в соответствии с ( III, 32 )
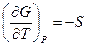 и
и  ,
,
то при Т = 0 
иными словами, процессы, протекающие в системе при абсолютно нуле, не изменяют её энтропии.
Планк расширил этот вывод, допустив, что энтропия всякого однородного кристаллического вещества равна нулю, т. е.
ST =0 = S 0 = 0
Теорему Нернста в сочетании с гипотезой Планка, касающейся значения энтропии в нулевой точке, принято называть третьим законом (началом) термодинамики (смотри § 4 второй главы).
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 786; Нарушение авторских прав?; Мы поможем в написании вашей работы!