
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методы расчета фугитивности (летучести)
|
|
|
|
Чтобы вычислить фугитивность, необходимо знать явную зависимость её от давления при постоянной температуре.
Энергия Гиббса как функция давления и температуры определяется по уравнению (III, 31):
dG = – SdT + VdP
Тогда при T = const оно сводится к виду dG =VdP.
Интегрирование этого уравнения для одного моля вещества дает следующий результат:
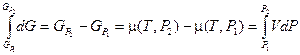
Если P 1®0, то свойства газа приближаются к свойствам идеального газа, т. е.  . Опуская индекс «2», в этом случае можем записать:
. Опуская индекс «2», в этом случае можем записать:
 , (V, 24)
, (V, 24)
(с учетом выражения Vид. для одного моля идеального газа из уравнения Менделеева‑Клапейрона).
Если принять во внимание, что для одного моля вещества в газообразном состоянии
 (V, 25)
(V, 25)
то подставив из (V, 19) и (III, 52) значения химического потенциала для реального и идеального газов, получим:
 (V, 26)
(V, 26)
Из сравнения уравнений (V, 24), (V, 25) и (V, 26)следует, что
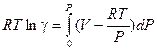
Или после простых преобразований:
 (V, 27)
(V, 27)
Разность  — это так называемая объемная поправка неидеального газа, учитывающая, что объем реального газа отличается от объема идеального газа.
— это так называемая объемная поправка неидеального газа, учитывающая, что объем реального газа отличается от объема идеального газа.
С учетом введенного обозначения уравнение (V, 27) можно переписать следующим образом:
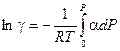 (V, 28)
(V, 28)
Полученное уравнение позволяет вычислять коэффициенты фугитивности (летучести) по экспериментальным данным. Величину интеграла находят графически по площади под кривой a = a(P) (смотри рис.22). При приближении кривой к значению Р = 0 ее приходится экстраполировать, что не представляет затруднений ввиду линейного хода кривой в области малых давлений. Представленный на рисунке график относится к водороду. Для абсолютного большинства других газов разность  стремится к нулю при
стремится к нулю при  , а при высоких давлениях значение a может принимать отрицательные значения.
, а при высоких давлениях значение a может принимать отрицательные значения.

Рис. 22. К графическому определению летучести газа по зависимости объемной поправки неидеального газа от давления.
Другой графический метод расчета основан на использовании коэффициента сжимаемости. Коэффициентом сжимаемости z называется отношение 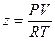 . Очевидно, что для идеального газа его значение равно единице, но отличается от единицы для реальных газов.
. Очевидно, что для идеального газа его значение равно единице, но отличается от единицы для реальных газов.
Если принять во внимание, что
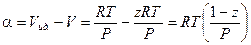
уравнение (V, 28) можно преобразовать к следующему виду:
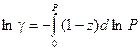
Полученный интеграл определяют графически по площади под кривой в координатах
(z – 1) – ln P.
Третий метод используют для определения коэффициента фугитивности (летучести) по изотермам идеального и реального газов в координатах P – V от достаточно низкого давления, при котором эти изотермы практически сливаются, до давления, при котором требуется определить фугитивность. Построим изотерму реального газа P = f (V) (кривая «b» на рис.23). Не представляет труда на этом же графике начертить идеальную изотерму  (кривая «а» на рис.23). Выберем два давления P2 и Р1 и проведем соответствующие им изобары. Продифференцируем уравнение(V, 19) при условии T = const:
(кривая «а» на рис.23). Выберем два давления P2 и Р1 и проведем соответствующие им изобары. Продифференцируем уравнение(V, 19) при условии T = const:
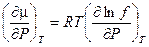
Принимая во внимание, что для одного моля газа 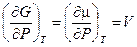
(смотри ( III, 32)), получим:
 или, помня о постоянстве температуры, можем записать
или, помня о постоянстве температуры, можем записать
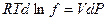
После интегрирования последнего уравнения имеем:

Из геометрических соображений (рис.23) следует, что интеграл 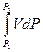 будет равен площади фигуры, ограниченной реальной изотермой, двумя изобарами и осью ординат, т. е. точками 122’1’. Из рисунка также следует, что указанный интеграл можно определить как разность, полученную вычитанием из площади фигуры 133’1’, ограниченной идеальной изотермой, двумя изобарами и осью ординат площади заштрихованной области 233’2’.
будет равен площади фигуры, ограниченной реальной изотермой, двумя изобарами и осью ординат, т. е. точками 122’1’. Из рисунка также следует, что указанный интеграл можно определить как разность, полученную вычитанием из площади фигуры 133’1’, ограниченной идеальной изотермой, двумя изобарами и осью ординат площади заштрихованной области 233’2’.
Площадь фигуры, ограниченной идеальной изотермой, определяется без труда, она равна интегралу

Следовательно,  , где символом «А» мы обозначили площадь заштрихованной области 233’2’.
, где символом «А» мы обозначили площадь заштрихованной области 233’2’.
Если теперь за Р 1 принять такое давление, при котором реальная и идеальная изотермы совпадут, что возможно при Р 1 ® 0, то летучесть будет равна давлению, т. е. ¦1 = Р 1.
В этом случае
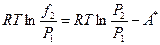 или
или
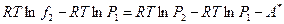 ,
,
где символом A * обозначена площадь всей фигуры, находящейся между верхней изобарой и обеими изотермами до точки их слияния.
Опуская индексы, после сокращений получим:

Следовательно, для определения летучести газа при заданном давлении Р нужно измерить площадь, заключенную между двумя изотермами от давления Р до Р = 0 или  . В последнем и заключается неудобство обсуждаемого метода, т. к. трудно строить изотермы в области больших объемов и решить, где же их оборвать. Другой недостаток метода заключается в том, что вычисление площади, ограниченной двумя кривыми, связано с дополнительными погрешностями.
. В последнем и заключается неудобство обсуждаемого метода, т. к. трудно строить изотермы в области больших объемов и решить, где же их оборвать. Другой недостаток метода заключается в том, что вычисление площади, ограниченной двумя кривыми, связано с дополнительными погрешностями.
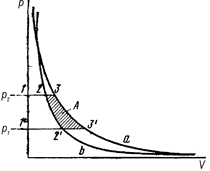
Рис. 23. Графическое определение летучести газа, где «а» — идеальная изотерма,
«b» — реальная изотерма.
Еще один метод определения фугитивности (летучести) основан на принципе соответственных состояний. Согласно этому принципу при одинаковых приведенном давлении  и приведенной температуре
и приведенной температуре  значения коэффициента фугитивности (летучести) для различных веществ должны быть одинаковыми. Из понятия соответственного состояния вытекает, что коэффициент сжимаемости z, который учитывает степень отклонения неидеальных систем от идеальной, в критическом состоянии для всех веществ должен быть одинаков:
значения коэффициента фугитивности (летучести) для различных веществ должны быть одинаковыми. Из понятия соответственного состояния вытекает, что коэффициент сжимаемости z, который учитывает степень отклонения неидеальных систем от идеальной, в критическом состоянии для всех веществ должен быть одинаков:  .
.
В действительности же, его величина зависит от природы вещества. На этом основании составлены таблицы, где при определении значений коэффициентов фугитивности (летучести) учитываются не только приведенные температура и давление, но и различные значения zкрит.. Таким образом, при близости вещества к насыщенному состоянию g = g(p, t, zкрит.).
Зависимость коэффициента фугитивности (летучести) от приведенного давления при различных приведенных температурах может быть представлена на графиках, используемых для тех же определений (смотри рис. 24).
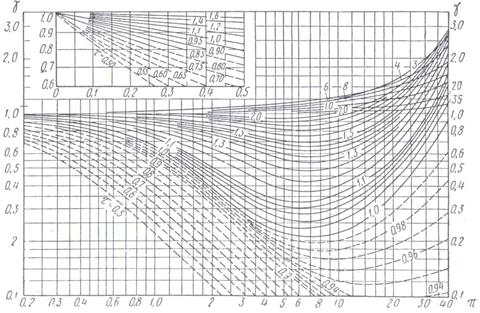
Рис. 24. Зависимость коэффициента летучести γ от приведенного давления π
и приведенной температуры τ.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 1184; Нарушение авторских прав?; Мы поможем в написании вашей работы!