
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Идеальный газ
|
|
|
|
ОСНОВНЫЕ ГАЗОВЫЕ ЗАКОНЫ
Характерными свойствами любого газа являются стремление занять как можно больший объём и сильная зависимость объёма от давления и температуры. Исходя из внешних признаков, газ – это такое состояние вещества, в котором вещество не имеет ни собственного определённого объёма, ни определённой формы.
Экспериментальным путём установлено, что объём любого газа зависит от трёх параметров: температуры – Т, давления – Р, числа молекул – N. Существуют законы, описывающие зависимость объёма от каждого из трёх параметров при постоянстве двух других:
1. Закон Бойля-Мариотта: при постоянной температуре объём данной массы газа обратно пропорционален давлению:
РV = const (T,N – const) (51)
При постоянной температуре объёмы данной массы газа обратно пропорциональны давлениям, под которыми находится газ:
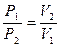 (52)
(52)
Плотности газа ρ и его концентрация С при постоянной температуре прямо пропорциональны давлениям:
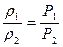 , (53)
, (53)
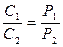 . (54)
. (54)
2. Законы Гей-Люссака – Шарля: при постоянном давлении объём данной массы газа прямо пропорционален абсолютной температуре:
V/T = const (P,N – const). (55)
При постоянном объёме давления данной массы газа прямо пропорциональны абсолютным температурам:
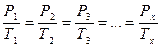 . (56)
. (56)
Плотности и концентрации газа, находящегося под постоянным давлением, изменяются обратно пропорционально абсолютным температурам:
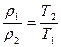 , (57)
, (57)
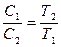 . (58)
. (58)
Зависимость между объёмами, давлениями и температурами для одной и той же массы газа выражается уравнением, объединяющим законы Бойля – Мариотта, Шарля и Гей – Люссака:
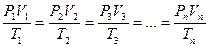 , (59)
, (59)
где V1 – объём газа при температуре Т1 и давлении Р1; V2 – объём газа при температуре Т2 и давлении Р2 и т.д.
3. Закон Авогадро: при постоянных температуре и давлении в равных объёмах газов содержится одинаковое число молекул
V/N = const (P,T – const)
Из закона Авогадро вытекает важное следствие: при одинаковых условиях молярные объёмы всех газов одинаковы. При нормальных условиях ( Р=1атм) молярный объём газа V0=22,4 л.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 502; Нарушение авторских прав?; Мы поможем в написании вашей работы!