
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Концентрации растворов
|
|
|
|
Жидкие бинарные системы
Двухкомпонентные системы
Основные понятия и определения
ФАЗОВЫЕ РАВНОВЕСИЯ
Фазой называется совокупность однородных частей системы (т.е. одинаковых по физическим, химическим и термодинамическим свойствам), отделённая от других частей системы физической (реально существующей) поверхностью раздела. Индивидуальное вещество в твёрдом агрегатном состоянии всегда образует самостоятельную фазу.
Жидкие и твёрдые фазы называются конденсированными.
Если вещество содержится одновременно в разных фазах, то происходит его переход из одной фазы в другую; такой переход называется фазовым. Состояние, при котором скорости противоположных фазовых переходов равны, называется фазовым равновесием.
Компонентами (составляющими веществами) называются все химические вещества, которые могут быть выделены из системы и существовать вне её.
Жидкие бинарные растворы – это гомогенные (однофазные) системы переменного состава, состоящие из двух или нескольких независимых компонентов.
В растворе компоненты равноценны, при этом одно из веществ называют растворителем, а другие – растворёнными веществами.
Растворителем считается вещество, которое до образования раствора находилось в жидком агрегатном состоянии, или, в общем случае, в том же агрегатном состоянии, что и раствор.
По своей природе растворы подразделяют на:
а) идеальные;
б) бесконечно разбавленные (предельно разбавленные);
в) реальные.
Идеальный раствор – это раствор, образование которого при любом соотношении компонентов, не сопровождается тепловым эффектом (ΔНраств =0), а также расширением или сжатием системы (объём раствора обладает свойством аддитивности):
Vр-ра = V1 + V2,
где V1 и V2 – соответственно объёмы первого и второго компонентов до образования раствора.
Ни в одном реально существующем растворе эти условия не выполняются.
Раствор считается бесконечно разбавленным, если концентрация растворённого вещества в нём бесконечно мала. В таком растворе взаимодействие между молекулами растворённого вещества отсутствует, так как они разделены бесконечно большим объёмом растворителя.
В практике бесконечно разбавленные растворы не встречаются, но к ним близки по свойствам растворы газов в жидкости, с которой они химически не взаимодействуют. В водных растворах это, например, N2 и Н2, но не СО2, который вступает в реакцию
СО2 + Н2О = Н2СО3.
На практике приходится иметь дело только с реальными растворами.
Способность вещества переходить в раствор называется растворимостью. Растворимость может быть неограниченной или ограниченной. Неограниченная растворимость присутствует только в таких системах, в которых и растворитель и растворённое вещество находятся в одинаковых фазах. Если растворитель и растворённое вещество находятся в разных по природе фазах, то растворимость ограничена некоторым пределом. При достижении предела растворимости между растворяемым веществом и образовавшимся раствором наступает равновесие.
Раствор, находящийся в данных условиях в равновесии с растворяемым веществом, называется насыщенным раствором.
Раствор, в котором при данных условиях предел растворимости не достигнут, называется ненасыщенным.
Одной из важнейших характеристик раствора является относительное содержание в нём растворённого вещества и растворителя, которое называется концентрацией. В общем случае концентрация обозначают буквой С. Качественно растворы делят на разбавленные, в которых растворённого вещества мало, и концентрированные, в котором растворённого вещества много.
В химии и смежных областях наиболее распространены следующие способы выражения концентрации:
Процентная концентрация (вес.%) выражается числом граммов растворённого вещества в 100 г раствора.
Молярная концентрация (молярность) выражается числом молей растворённого вещества в 1 л раствора.
Нормальная концентрация (нормальность) выражается числом грамм-эквивалентов растворённого вещества в 1 л раствора.
Моляльная концентрация (моляльность) выражается числом молей растворённого вещества, содержащегося в 1000 г растворителя.
Молярная доля показывает, какую часть от общего числа молей раствора составляет растворённое вещество или растворитель. Если обозначим число молей растворителя через na, а число молей растворённого вещества через nb, то молярную долю растворённого вещества можно выразить
Nв = 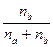 , (69)
, (69)
а мольную долю растворителя
NА =  . (70)
. (70)
Сумма NА + Nв = 1.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 629; Нарушение авторских прав?; Мы поможем в написании вашей работы!