
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение состояния идеального газа. В процессе разработки молекулярно-кинетичской теории газов для понимания общих законов была выдвинута идея существования гипотетического газа
|
|
|
|
В процессе разработки молекулярно-кинетичской теории газов для понимания общих законов была выдвинута идея существования гипотетического газа, который строго подчиняется газовым законам при любых температурах и давлении. Этот газ назвали идеальным газом.
В идеальном газе молекулы рассматриваются как материальные точки, размеры которых бесконечно малы по сравнению с расстоянием между ними. Кроме того, считается, что столкновение молекул идеально упруги, то есть кроме передачи кинетической энергии никаких других взаимодействий между молекулами идеального газа не существует.
Для одного моля идеального газа
 (60)
(60)
Постоянная R называется универсальной газовой постоянной и её значение при нормальных условиях (Р=1,013·105 Па, Т=273К, V0=22,4 л) равно
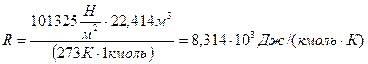
или R=8,314 Дж/(моль∙К).
Для n молей идеального газа справедливо выражение
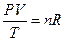 или PV = nRT.
или PV = nRT.
Поскольку n=m/M, где m – это масса газа, а M – его молекулярная масса, то
PV = 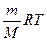 . (61)
. (61)
Уравнение (61) известно как уравнение Менделеева – Клапейрона, оно связывает все параметры, влияющие на состояние газа. В подавляющем большинстве случаев принимается, что в газообразном состоянии все вещества ведут себя как идеальный газ при давлениях, близких к атмосферному (101,3 кПа) и ниже.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 505; Нарушение авторских прав?; Мы поможем в написании вашей работы!